Versuch - Reaktionen von Metallen mit Metallsalzlösungen
Versuch Redoxreaktionen -2016-05-21- 01 Blei Kupfer und Silber in Zinksulfatlösung – MPEG
https://youtu.be/MpbRg0EkVUM
Versuch Redoxreaktionen -2016-05-21- 02 Zink Silber und Blei in Kupfersulfatlösung – MPEG
Versuch Redoxreaktionen -2016-05-21- 03 Kupfer Blei und Zink in Silbernitratlösung – MPEG
https://youtu.be/qF68AWXD-HI
Versuch Redoxreaktionen -2016-05-21- 04 Zink Silber und Kupfer in Bleisulfatlösung – MPEG
https://youtu.be/grnyQQ8r2Gw
Mitschrift von Simon Müller am 13.11.2017

Reaktionen von Metallen mit Metallsalzlösungen
Versuchsreihe: Reaktionen von Metallen (Me) mit Metallsalzlösungen (Mez+)
|
|
Zn2+ |
Pb2+ |
Cu2+ |
Ag+ |
|
Zn |
0 |
|
|
|
|
Pb |
|
0 |
|
|
|
Cu |
|
|
0 |
|
|
|
|
|
|
0 |
0 = Versuch macht keinen Sinn!
Versuchsergebnisse: Reaktionen von Metallen (Me) mit Metallsalzlösungen (Mez+)

Versuch - Reaktionen von Metallen mit Metallsalzlösungen
Versuchsergebnisse:
|
|
Zn2+ |
Pb2+ |
Cu2+ |
Ag+ |
|
Zn |
0 |
+a |
+b |
+c |
|
Pb |
- |
0 |
+d |
+e |
|
Cu |
- |
- |
0 |
+f |
|
Ag |
- |
- |
- |
0 |
0 = Versuch macht keinen Sinn! + = Reaktion - = keine Reaktion
Wenn eine Reaktion stattfindet, dann lässt sich dies daran erkennen, dass sich auf dem Metall ein anderes Metall als fester Belag abscheidet.
Einige Anmerkungen für Experten:
- Man darf ungeladene Metalle (Zn, Pb, Cu Ag) und ionenhaltige Metallsalzlösungen (mit Zn2+, Pb2+, Cu2+ und Ag+ –Ionen) nicht verwechseln:
Silbersalzlösungen enthalten Ag+-Ionen und sind im Gegensatz zu metallischem Silber (Ag) sehr reaktionsfreudig! Eine Kupfersulfatlösung enthält Cu2+-Ionen
- Bei Hauptgruppenelementen lässt sich die Ladung der Metallionen meist recht einfach mit der Hauptgruppennummer bestimmen:
Natrium Na steht in der I. Hauptgruppe und bildet einfach positiv geladene Na+-Ionen.
Aluminium Al steht in der III. Hauptgruppe des Periodensystems und bildet Al3+-Ionen. Eine Ausnahme bildet aber z. B. das Hauptgruppenlement Blei. Als Element der IV. Hauptgruppe sollte es eigentlich nur Pb4+-Ionen bilden, es bildet aber auch gerne Pb2+-Ionen. Warum das so ist, ist eine gute Frage (vgl.: https://www.gutefrage.net/frage/ladung-von-blei), die uns aber im Rahmen der Schulchemie wirklich nicht weiter beschäftigen soll!
- Bei Nebengruppenelementen kann man sich in Bezug auf die Ladung nie sicher sein.
Die Ladung von Nebengruppenelementen wie Fe, Ni, Co, Zn, Ag und Au lässt sich nur schwer vorhersagen. Oft bilden sie zweifach positiv geladene Ionen wie Fe2+, Ni2+, Co2+, Cu2+ oder Zn2+. Es
gibt aber z. B. auch Fe3+ und Cu+-Ionen!
Silber bildet Ag+-Ionen, Gold bildet Au3+-Ionen.
- In den Metallsalzlösungen finden sich neben den positiv geladenen Metallionen auch negativ geladene „Gegenionen“: Eine Kupfersulfatlösung CuSO4(aq) enthält z. B. Cu2+ und SO42- -Ionen. Eine Silbernitratlösung AgNO3(aq) enthält Ag+ und NO3- -Ionen. Eine Eisen(II)chloridlösung FeCl2(aq) enthält Fe2+-Ionen und Cl--Ionen im Verhältnis 1 : 2.
Eine Eisen(III)chloridlösung FeCl3(aq) enthält Fe3+-Ionen und Cl--Ionen im Verhältnis 1 : 3.
Wenn eine Reaktion abläuft, dann lässt sich auch eine Gleichung formulieren.
Die Reaktionsgleichungen für die ablaufenden Reaktionen lauten:
|
a) Zink reagiert mit einer Bleisulfatlösung: |
||||
|
Oxidation: |
Zn |
=> |
Zn2+ + 2 e- |
Der Zinkstab löst sich auf. |
|
Reduktion: |
Pb2+ + 2 e- |
=> |
Pb |
Auf dem Zinkstab scheidet sich Blei als Belag ab |
|
Redoxreaktion: |
Zn + Pb2+ |
=> |
Zn2+ + Pb |
|
|
oder: |
Zn + Pb2+ + SO42- |
=> |
Zn2+ + Pb + SO42- |
|
|
b) Zink reagiert mit einer Kupfersulfatlösung (verläuft ähnlich wie a): |
||||
|
Oxidation: |
Zn |
=> |
Zn2+ + 2 e- |
Der Zinkstab löst sich auf. |
|
Reduktion: |
Cu2+ + 2 e- |
=> |
Cu |
Auf dem Zinkstab scheidet sich Kupfer als Belag ab |
|
Redoxreaktion: |
Zn + Cu2+ |
=> |
Zn2+ + Cu |
|
|
oder: |
Zn + Cu2+ + SO42- |
=> |
Zn2+ + Cu + SO42- |
|
|
c) Zink reagiert mit einer Silbernitratlösung |
||||
|
Oxidation: |
Zn |
=> |
Zn2+ + 2 e- |
Der Zinkstab löst sich auf. |
|
Reduktion: |
Ag+ + e- |
=> |
Ag | ∙ 2* |
Auf dem Zinkstab scheidet sich Silber als Belag ab. |
|
* Die Teilgleichung für die Reduktion muss mit dem Faktor „2“ multipliziert werden, damit die Zahl der aufgenommenen und der abgegebenen Elektronen gleich ist! |
||||
|
Redoxreaktion: |
Zn + 2 Ag+ |
=> |
Zn2+ + 2 Ag |
|
|
oder: |
Zn + 2 Ag+ + 2 NO3- |
=> |
Zn2+ + 2 Ag + 2 NO3- |
|
|
d) Blei reagiert mit einer Kupfersulfatlösung (verläuft ähnlich wie a und b): |
||||
|
Oxidation: |
Pb |
=> |
Pb2+ + 2 e- |
Der Bleistab löst sich auf. |
|
Reduktion: |
Cu2+ + 2 e- |
=> |
Cu |
Auf dem Bleistab scheidet sich Kupfer als Belag ab |
|
Redoxreaktion: |
Pb + Cu2+ |
=> |
Pb2+ + Cu |
|
|
oder: |
Pb + Cu2+ + SO42- |
=> |
Pb2+ + Cu + SO42- |
|
|
e) Blei reagiert mit einer Silbernitratlösung (verläuft ähnlich wie c und f!): |
||||
|
Oxidation: |
Zn |
=> |
Zn2+ + 2 e- |
Der Bleistab löst sich auf. |
|
Reduktion: |
Ag+ + e- |
=> |
Ag | ∙ 2* |
Auf dem Bleistab scheidet sich Silber als Belag ab. |
|
* Die Teilgleichung für die Reduktion muss mit dem Faktor „2“ multipliziert werden, damit die Zahl der aufgenommenen und der abgegebenen Elektronen gleich ist! |
||||
|
Redoxreaktion: |
Zn + 2 Ag+ |
=> |
Zn2+ + 2 Ag |
|
|
oder: |
Zn + 2 Ag+ + 2 NO3- |
=> |
Zn2+ + 2 Ag + 2 NO3- |
|
Oxidation = Abgabe von Elektronen (Elektronen stehen rechts!)
Oxidation = Erhöhung der Oxidationszahl (OZ), z. B. von Zn (OZ = 0) auf Zn2+ (OZ = +II)
Reduktion = Aufnahme von Elektronen (Elektronen stehen links!)
Reduktion = Reduktion der Oxidationszahl (OZ), z. B. von Ag+ (OZ = +I) auf Ag (OZ = 0)
Wenn man eine Redoxreihe in der oben genannten Form (reduzierte Form des Redoxpaares steht links, oxidierte Form des Redoxpaares steht rechts, unedle Metalle oben, edle Metalle unten) aufstellt, dann gilt:

- „Bergabreaktionen“ sind möglich
- „Bergabreaktionen“ sind nicht möglich
Auf der Grundlage der oben dargestellten Versuche lässt sich folgende Redoxreihe aufstellen:
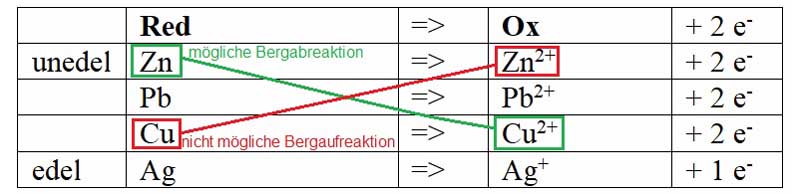
Mit Hilfe der dargestellten Redoxreihe kann man erkennen, dass Kupfer (Cu) in einer „Bergabreaktion“ mit Ag+-Ionen reagieren kann:

Man sollte erkennen: Wenn es zu einer Reaktion kommt, dann reagiert Cu zu Cu2+ und das Ag+ zu Ag!
|
Kupfer reagiert mit einer Silbernitratlösung |
||||
|
Oxidation: |
Cu |
=> |
Cu2+ + 2 e- |
Der Kupferstab löst sich auf. |
|
Reduktion: |
Ag+ + e- |
=> |
Ag | ∙ 2* |
Auf dem Kupferstab scheidet sich Silber als Belag ab. |
|
* Die Teilgleichung für die Reduktion muss mit dem Faktor „2“ multipliziert werden, damit die Zahl der aufgenommenen und der abgegebenen Elektronen gleich ist! |
||||
|
Redoxreaktion: |
Cu + 2 Ag+ |
=> |
Cu2+ + 2 Ag |
|
|
oder: |
Cu + 2 Ag+ + 2 NO3- |
=> |
Cu2+ + 2 Ag + 2 NO3- |
|
In der Formelsammlung für die zentrale Chemie-Abiturprüfung findet sich eine Redoxreihe, die in der „üblichen“ Form aufgebaut ist: Die reduzierte Form des Redoxpaares steht links, die oxidierte Form des Redoxpaares steht rechts, unedle Metalle oben, edle Metalle unten. Es handelt sich also um eine Redoxreihe, in der „Bergabreaktionen“ möglich und „Bergaufreaktionen“ nicht möglich sind:

Verändert übernommen aus folgender Quelle: Gemeinsame Abituraufgabenpools der Länder. Aufgaben für die Fächer Mathematik, Chemie und Physik Mathematisch-naturwissenschaftliche Formelsammlung
https://www.iqb.hu-berlin.de/abitur/abitur/dokumente/mathematik/M_Mathematischna.pdf
