Atommodell nach Ernes Rutherford I musstewissen Chemie
https://www.youtube.com/watch?v=zeBywJUkepk
sehenswert
Rutherfords Streuversuch ● Gehe auf SIMPLECLUB.DE/GO & werde #EinserSchüler
Sir Joseph John Thomson (häufig auch J. J. Thomson; * 18. Dezember 1856 in Cheetham Hill bei Manchester; † 30. August 1940 in Cambridge) war ein britischer Physiker und Nobelpreisträger für Physik. Er entdeckte 1897 – etwa zeitgleich mit dem deutschen Physiker Emil Wiechert – das Elektron.

Thomsonsches Atommodell
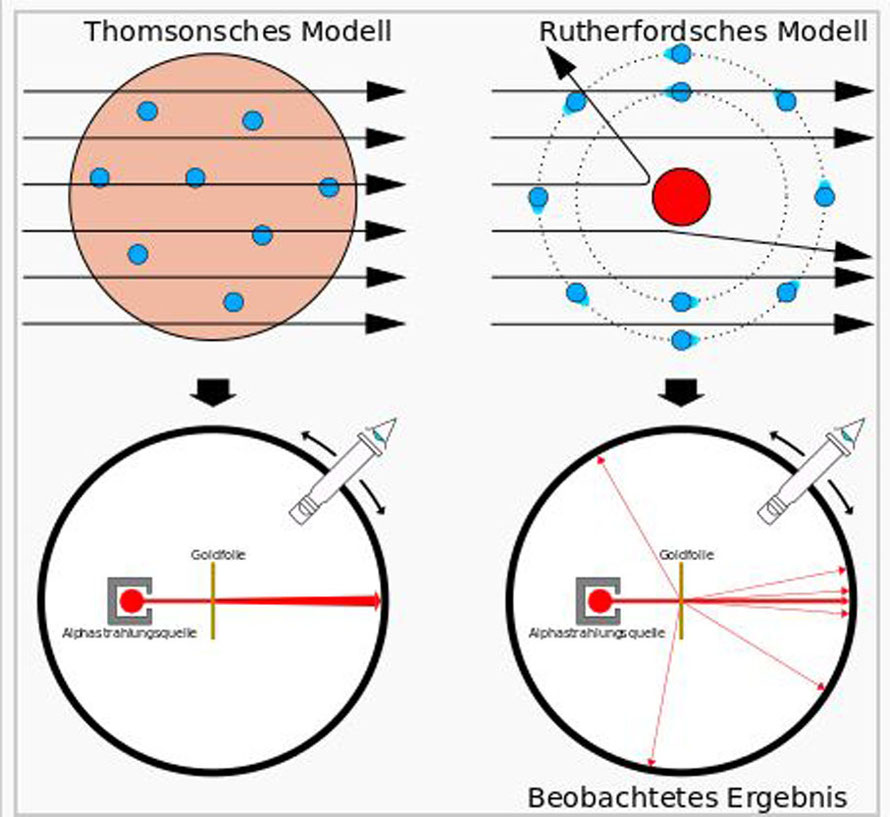
Das thomsonsche Atommodell ist ein Atommodell, nach dem das Atom aus gleichmäßig verteilter, positiv geladener Masse besteht, in der sich die negativ geladenen Elektronen bewegen. Es wurde 1903 von Joseph John Thomson entwickelt. Aufgrund der angenommenen Anordnung der Elektronen in der Masse, vergleichbar mit Rosinen in einem Kuchen, wird es auch als Plumpudding- oder Rosinenkuchenmodell bezeichnet.
Quelle: Seite „Thomsonsches Atommodell“. In: Wikipedia, Die freie Enzyklopädie. Bearbeitungsstand: 8. September 2016, 10:54 UTC. URL:https://de.wikipedia.org/w/index.php?title=Thomsonsches_Atommodell&oldid=157759963 (Abgerufen: 11. September 2016, 17:48 UTC)
Filmtipp - Das Atom - John Dalton und Niels Bohr - Meilensteine der Naturwissenschaft und Technik
https://www.dailymotion.com/video/x2nyf0l
Der Streuversuch von Rutherford wird ab Sendeminute 5 dargestellt.
Filmtipps zum Rutherfordschen Streuversuch
Telekolleg Multimedial Physik 27 Klein aber oho das Atom
https://www.youtube.com/watch?v=ZaLz9LrYTu4
Der Rutherfordschen Streuversuch ist Thema acht bis zehn
The Atom song: Dalton, Thomson, Rutherford and Bohr ..
http://de.youtube.com/watch?v=vUzTQWn-wfE
Das Atom - John Dalton und Niels Bohr - Meilensteine der Naturwissenschaft und Technik
https://www.dailymotion.com/video/x2nyf0l
Der Streuversuch von Rutherford wird ab Sendeminute 5 dargestellt
Simulation - Thomson und Rutherford - zwei Atommodelle im Vergleich
https://youtu.be/S2B7EoD3WQA
Die Ansicht und der Download der Simulation „Rutherford Streuung“ ist im September 2016 möglich unter folgender URL:
http://phet.colorado.edu/de/simulatio... (Website der Universität Colorado).
Damit die Simulationen „laufen“, ist in der Regel die Installation der neuesten Java-Version notwendig.
Rutherfordscher Streuversuch (Manchester, 1909–1913)
Aufbau und Versuchsdurchführung

Versuchsaufbau: 1: Radioaktives Radium, 2: Bleimantel zur Abschirmung, 3: Alpha-Teilchenstrahl, 4: Leuchtschirm bzw. Fotografieschirm 5: Goldfolie 6: Punkt, an dem die Strahlen auf die Folie treffen, 7: Teilchenstrahl trifft den Schirm, nur wenige Teilchen werden abgelenkt.
Quelle: Seite „Rutherford-Streuung“. In: Wikipedia, Die freie Enzyklopädie. Bearbeitungsstand: 26. August 2016, 21:56 UTC. URL: https://de.wikipedia.org/w/index.php?title=Rutherford-Streuung&oldid=157412514 (Abgerufen: 12. September 2016, 21:31 UTC)
In einen Bleiblock mit Öffnung zu einer Seite hin wird ein radioaktiver Stoff gelegt, der Strahlung abgibt: Alpha-, Beta- und Gamma-Strahlung. Die aus der Öffnung im Bleiblock austretenden Strahlen werden durch ein elektrisches Feld geleitet um sie voneinander zu trennen. Dadurch werden die negativen Elektronen (Beta-Strahlen) zum positiven Pol und die positiven Helium-Atomkerne (Alpha-Strahlen) zum negativen Pol abgelenkt, während die Richtung der ungeladenen Photonen(Gamma-Strahlen) unverändert bleibt. Die Alpha-Strahlung wird senkrecht auf eine 0,5 μm dünne Goldfolie (ca. 1000 Atome hintereinander) gerichtet. Die aus der Folie austretende Strahlung lässt sich danach mit einem Leuchtschirm oder einem daran befestigten Film sichtbar machen. (Gold wurde verwendet, da es sich schon damals mit einfachen mechanischen Mitteln zu sehr dünnen Schichten verarbeiten ließ und eine hohe Atommasse besitzt. Daher stammt auch die Bezeichnung Goldfolienexperiment.)
Bis dahin galt das Modell von J. J. Thomson, bei dem die positive Ladung des Atoms homogen in einer Kugel verteilt ist (thomsonsches Atommodell).
Beteiligt an diesen Experimenten waren Hans Geiger, Ernest Marsden und Ernest Rutherford.
Bei der Betrachtung der Messergebnisse ... soll Rutherford gesagt haben: „Dies ist so unwahrscheinlich, als ob man mit einer Pistole auf einen Wattebausch schießt, und die Kugel zurückprallt.“
Beobachtung:
- Fast alle Alpha-Teilchen können die Goldfolie ungehindert passieren.
- Nur bei ca. 1 von 100.000 Alpha-Teilchen wird die Richtung geändert.
- Je größer der Streuwinkel, desto seltener tritt diese Ablenkung auf.
- Auch Streuwinkel von über 90° treten äußerst selten auf.
- Einige Alpha-Teilchen werden zurück gestreut.
Interpretation
Die extrem seltene Ablenkung der Alpha-Teilchen und deren Winkelverteilung lassen sich dadurch verstehen, dass sich in den Atomen nur ein sehr kleines Massezentrum befindet, das positiv geladen ist. Man nennt dieses Massezentrum den Atomkern. Da die meisten Teilchen die Goldfolie ungehindert passieren, muss zwischen den Kernen ein großer Freiraum bestehen. Dieses Ergebnis führte zu dem rutherfordschen Atommodell. (Die Elektronen, welche sich in dem relativ zum Kerndurchmesser riesigen leeren Raum (Vakuum) um den Kern bewegen, schirmen die konzentrierte positive Kern-Ladung ab, sodass das Atom nach außen hin neutral erscheint.)
Unterrichtsmitschrift von Sarah Schiemann am 12.09.2016


