Angaben im Periodensystem der Elemente

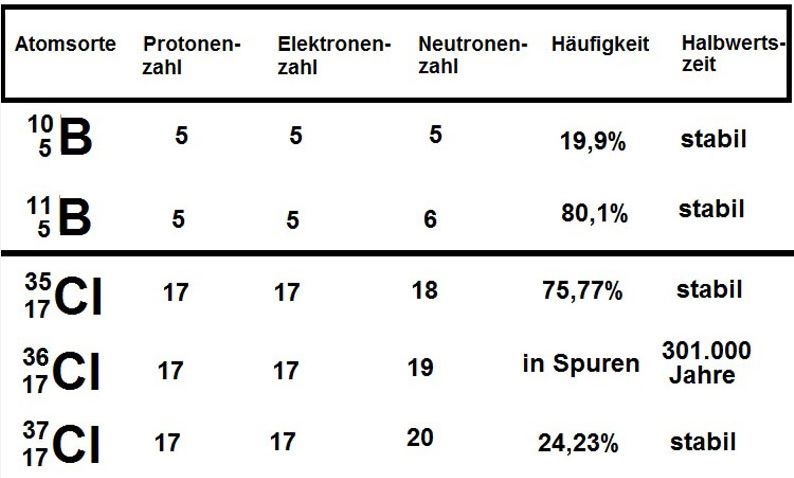
Atomsorten (Isotope) der Elemente B und Cl
Ein Widerspruch?
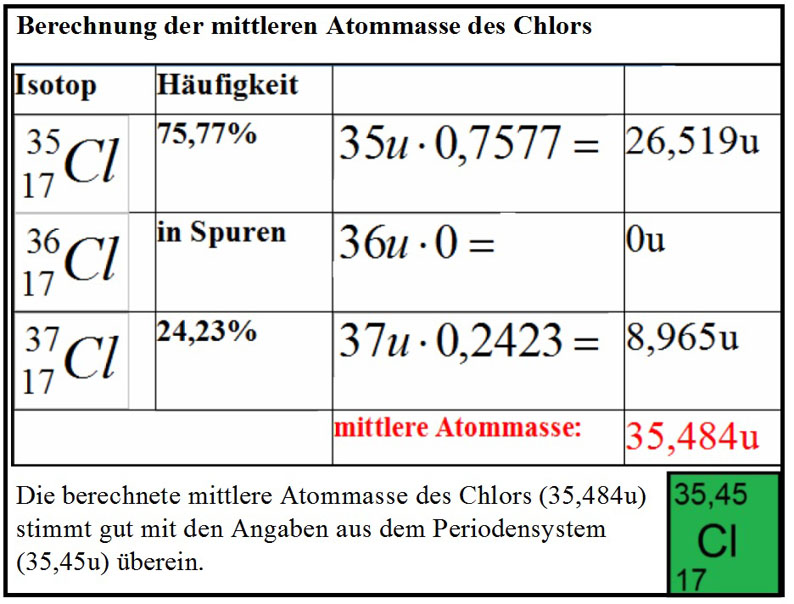
Neutronen und Protonen haben jeweils eine Masse von 1u, die Elektronen sind vergleichsweise masselos. Die Atommassen sollten daher nur unwesentlich von ganzzahligen Werten abweichen.
Ein Blick ins Periodensystem zeigt aber beispielsweise für das Bor eine Atommasse von 10,81u und fur das Chlor eine Atommasse von 35,45u.
Simulation Massenspektrograph Version 2 0 MS des Elementes B
https://www.youtube.com/watch?v=IwYi2_vzeoQ&feature=youtu.be
Massenspektrograph 2.0
Auf www.physiksimulation.de gibt es zahlreiche Simulationen physikalischer Vorgänge und Versuche.
Hier findet sich auch das Programm Massenspektrograph 2.0 - kostenlos zum Herunterladen! Der Download der Software ist im Oktober 2016 auch möglich unter der folgenden URL: https://www.freeware.de/download/massenspektrograph/
Die Software eignet sich gut zur Darstellung der unterschiedlichen Atommassen der Isotope eines Elementes: Massenpektrograph nach Bainbridge und z.B. das Element Bor auswählen, dann Simulation starten ...
Als Isotope bezeichnet man Arten von Atomen, deren Atomkerne gleich viele Protonen (gleiche Ordnungszahl), aber verschieden viele Neutronen enthalten. Sie haben dann verschiedene Massenzahlen, stellen aber das gleiche Element dar; es gibt also die Sauerstoffisotope, die Eisenisotope usw. Die Isotope eines Elements verhalten sich chemisch fast identisch.
Die Bezeichnung Isotop ist älter als der Begriff Nuklid, der ganz allgemein „Atomart“ bedeutet. „Isotop“ wird daher nach wie vor oft auch im Sinne von Nuklid benutzt, d. h. auch dann, wenn nicht nur von Atomen eines und desselben Elements die Rede ist.
Von den 91 natürlich vorkommenden Elementen werden in der Natur 69 als Gemische mehrerer Isotope (Mischelemente) vorgefunden. Die übrigen 22 heißen Reinelemente. Das chemische Atomgewicht von Mischelementen ist der Durchschnittswert der verschiedenen Atommassen der beteiligten Isotope.
Der Name (von griechisch ἴσος ísos „gleich“ und τόπος tópos „Ort, Stelle“) kommt daher, dass die Isotope eines Elements im Periodensystem am gleichen Ort stehen. Getrennt voneinander dargestellt werden sie in einer Nuklidkarte. Der Begriff Isotop wurde von Frederick Soddy geprägt, der für seine Arbeiten und Erkenntnisse im Bereich der Isotope undRadionuklide 1921 den Nobelpreis für Chemie erhielt.
Quelle: Seite „Isotop“. In: Wikipedia, Die freie Enzyklopädie. Bearbeitungsstand: 20. März 2016, 20:45 UTC. URL:https://de.wikipedia.org/w/index.php?title=Isotop&oldid=152696775 (Abgerufen: 11. September 2016, 16:43 UTC)
Stabile Isotope der Elemente Bor und Chlor

Der Download der oben gezeigten Simulation "Isotope und Atommasse" ist im Oktober 2016 möglich unter der folgenden URL: https://phet.colorado.edu/de/simulation/isotopes-and-atomic-mass
Ausschnitt aus der Nuklidkarte

Reinelemente und Mischelemente
Ein Reinelement ist ein chemisches Element, von dem in der Natur nur ein einziges stabiles Isotop existiert.
Reinlemente sind: Beryllium, Fluor, Natrium, Aluminium, Phosphor, Scandium, Mangan, Cobalt, Arsen, Yttrium, Niob, Rhodium, Iod, Casium, Praseodym, Terbium, Holmium, Thulium, Gold, Wismut, Thorium und Plutonium.
Alle anderen Elemente nennt man Mischelemente.
Aufgabe für Experten: Auch ohne Auch ohne eine Nuklidkarte
kann man in vielen Fallen mit Hilfe eines Periodensystems erkennen, dass es sich bei einem Element um ein Mischelement handelt. Wie ist dies möglich?
