n-Alkane
| C | Name | Summenformel | Molare Masse | Schmelzpunkt | Siedepunkt | Dichte | Kugel-Stab-Modell |
|---|---|---|---|---|---|---|---|
| 1 | Methan | CH4 | 16,04 g·mol−1 | 90,65 K | 111,4 K |
0,72 kg/m3 (gasförmig, 0 °C, 1013 hPa) |
|
| 2 | Ethan | C2H6 | 30,07 g·mol−1 | 90 K | 185 K |
1,36 kg/m3 (gasförmig, 0 °C, 1013 hPa) |
|
| 3 | Propan | C3H8 | 44,10 g·mol−1 | 85 K | 231 K |
2,01 kg/m3 (gasförmig, 0 °C, 1013 hPa) |
|
| 4 | n-Butan | C4H10 | 58,12 g·mol−1 | 135 K | 272,5 K |
2,71 kg/m3 (gasförmig, 0 °C, 1013 hPa) |
|
| 5 | n-Pentan | C5H12 | 72,15 g·mol−1 | 144 K | 309 K | 0,626 g/cm3 | |
| 6 | n-Hexan | C6H14 | 86,18 g·mol−1 | 178 K | 342 K | 0,659 g/cm3 | |
| 7 | n-Heptan | C7H16 | 100,2 g·mol−1 | 182 K | 371 K | 0,684 g/cm3 | |
| 8 | n-Octan | C8H18 | 114,2 g·mol−1 | 216 K | 399 K | 0,703 g/cm3 | |
| 9 | n-Nonan | C9H20 | 128,3 g·mol−1 | 222 K | 424 K | 0,718 g/cm3 | |
| 10 | n-Decan | C10H22 | 142,3 g·mol−1 | 243 K | 447 K | 0,73 g/cm3 | |
| 11 | n-Undecan | C11H24 | 156,3 g·mol−1 | 248 K | 469 K | 0,74 g/cm3 | |
| 12 | n-Dodecan | C12H26 | 170,3 g·mol−1 | 263 K | 489 K | 0,75 g/cm3 |
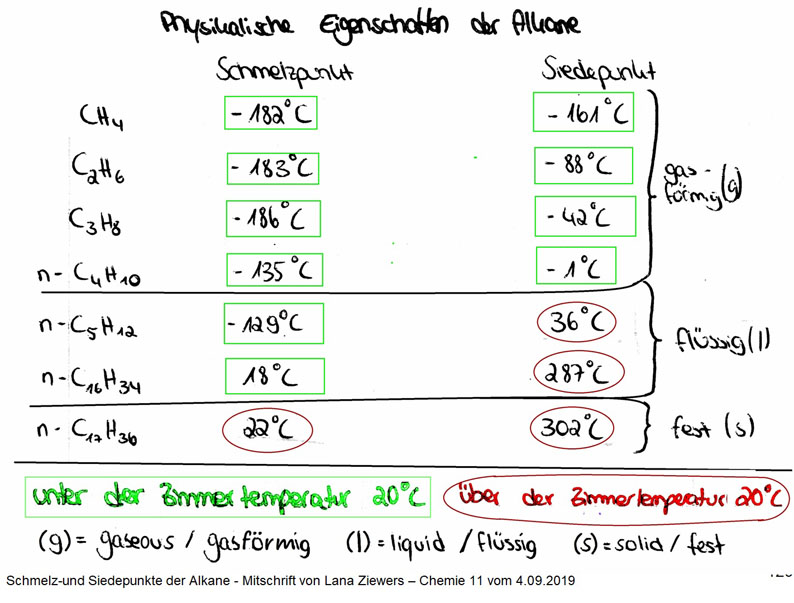
Mitschrift von Lana Ziewers - Ch11 vom 4.09.2019

Siedepunkte der unverzweigten n-Alkane – vom Methan bis zum Hexan

Unterrichtsmitschrift vom 21.09.2016 - Lk11 (Simon Müller)


Siedepunkte von Alkanen – eine zusammenfassende Erklärung
1. Je stärker die zwischenmolekuren (intermolekularen) Wechselwirkungen zwischen den Teilchen eines Stoffes, desto größer ist der Siedepunkt.
2. Der Siedepunkt der Alkane wird durch schwache Van der Waals-Kräfte (Anziehungskräfte zwischen unpolaren Molekülen) bestimmt.
3. Die Stärke der Van der Waals-Kräfte nimmt mit der Moleküloberfläche zu.
4. Über die Größe der Moleküloberfläche entscheidet zunächst die Kohlenstoffzahl:
Je höher die Kohlenstoffzahl eines Alkans, desto höher sind seine Moleküloberfläche und sein Siedepunkt.
5. Bei gleicher Kohlenstoffzahl entscheidet der „Verzweigungsgrad“ des Alkans:
Da sich verzweigte Moleküle einer kompakten Kugelform annähern, besitzen sie – im Vergleich zu unverzweigten Molekülen – eine geringere Moleküloberfläche und können sich nicht so gut aneinander annähern:
Je größer der Verzweigungsgrad eines Alkans, desto kleiner sind seine Moleküloberfläche und sein Siedepunkt.
Filmtipp: Welche Eigenschaften haben Alkane?!






