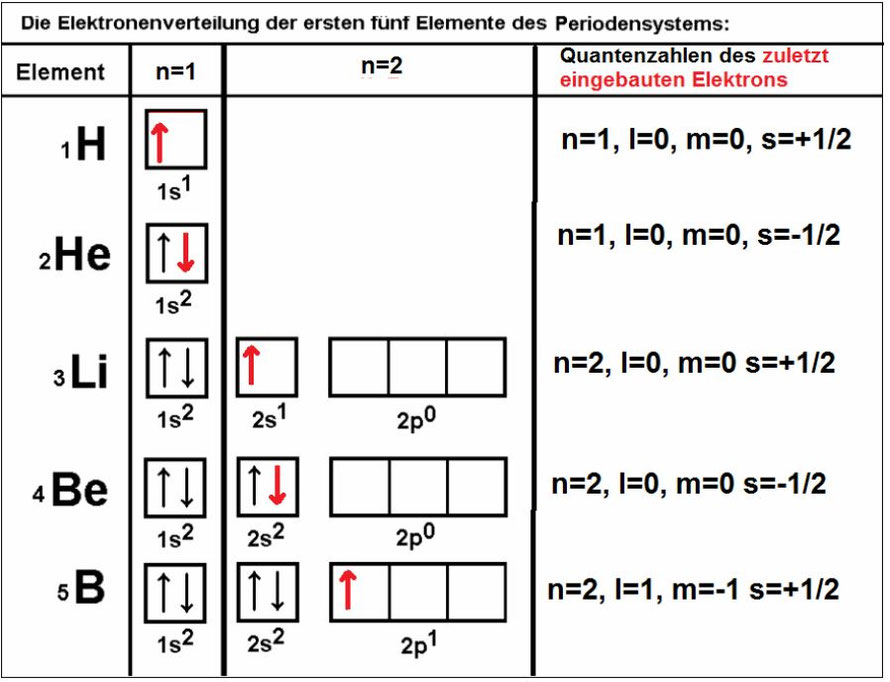
Elektronenverteilung des Kohlenstoffs

Die Hundsche Regel der Chemie
In der Chemie wird oft nur eine einzige Hundsche Regel verwendet, die 1927 von Friedrich Hund selbst rein empirisch gefunden wurde und inhaltlich der zweiten der oben aufgeführten Regeln entspricht. Sie besagt: Wenn für die Elektronen eines Atoms mehrere Orbitale/Nebenquanten mit gleichem Energieniveau zur Verfügung stehen, werden diese zuerst mit je einem Elektron mit parallelem Spin besetzt (formeller Begriff: „Maximale Multiplizität“). Erst wenn alle Orbitale des gleichen Energieniveaus mit jeweils einem Elektron gefüllt sind, werden sie durch das zweite Elektron vervollständigt.
Einfacher formuliert: Energiegleiche Orbitale werden zunächst einfach besetzt.
Seite „Hundsche Regeln“. In: Wikipedia, Die freie Enzyklopädie. Bearbeitungsstand: 1. März 2016, 22:17 UTC. URL: https://de.wikipedia.org/w/index.php?title=Hundsche_Regeln&oldid=152084335 (Abgerufen: 28. September 2016, 19:06 UTC)


Bei der Elektronenverteilung des Elementes Kalium und den darauf folgenden Elementen fällt auf, dass das 4s-Orbital vor dem 3d-Orbitalen besetzt wird.
Die Faustregel „innere Schalen sind günstiger als äußere“ gilt also nicht immer!
Die Orbitale werden in folgender Reihenfolge besetzt:

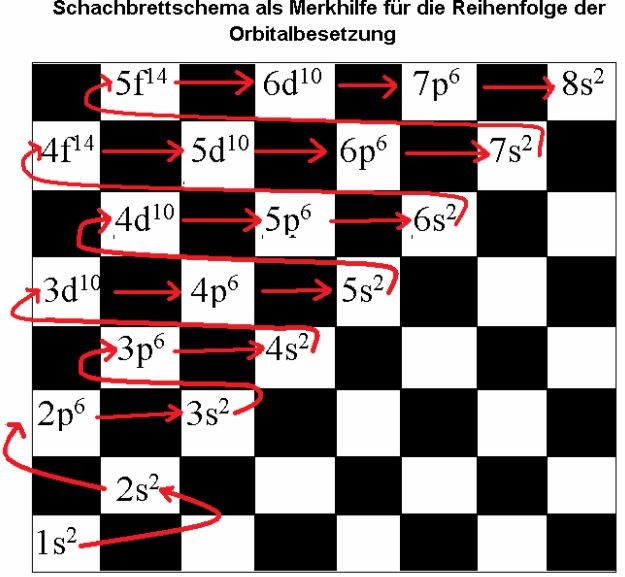
Eine "alte" Unterrichtsmitschrift


Unterrichtsmitschrift von Sarah Schiemann (Grundkurs ch12) vom 4.10.2016

Übungsaufgabe mit Lösung

Noch eine Übungsaufgabe mit Lösung

