
Der Effekt von Chloroform auf James Young Simpson und Freunde
https://de.wikipedia.org/wiki/Chloroform#/media/File:Effects_of_chloroform_(historical)-3.jpg
Seite „Chloroform“. In: Wikipedia, Die freie Enzyklopädie. Bearbeitungsstand: 14. Mai 2017, 12:01 UTC. URL: https://de.wikipedia.org/w/index.php?title=Chloroform&oldid=165491559 (Abgerufen: 16. Mai 2017, 09:27 UTC)
Chloroform
Chloroform (systematische Bezeichnung Trichlormethan) ist ein chlorierter Kohlenwasserstoff mit der Summenformel CHCl3.
Eigenschaften von Cloroform
Trichlormethan ist eine farblose, nicht entflammbare, flüchtige Flüssigkeit von süßlichem Geruch. Der Schmelzpunkt liegt bei −63 °C, der Siedepunkt unter Normaldruck bei 61 °C.
Die Dämpfe von Chloroform verursachen Bewusstlosigkeit und senken die Schmerzempfindung. Wegen der toxischen Wirkung auf Herz, Leber und andere innere Organe wird Chloroform heute nicht mehr als Narkosemittel angewendet. Es steht außerdem unter Verdacht, krebserregend zu sein.
Seite „Chloroform“. In: Wikipedia, Die freie Enzyklopädie. Bearbeitungsstand: 14. Mai 2017, 12:01 UTC. URL: https://de.wikipedia.org/w/index.php?title=Chloroform&oldid=165491559 (Abgerufen: 16. Mai 2017, 09:27 UTC)
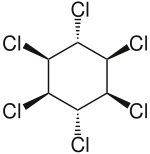
Lindan
| Strukturformel | |
|---|---|
|
|
| Allgemeines | |
| Name | Lindan |
| Andere Namen |
|
| Summenformel | C6H6Cl6 |
Lindan beziehungsweise γ-Hexachlorcyclohexan ist ein Halogenkohlenwasserstoff, der vor allem als Insektizid genutzt wird.
Geschichte
Lindan wurde erstmals 1825 durch Michael Faraday hergestellt. Benannt ist es nach dem niederländischen Chemiker Teunis van der Linden (1884–1965), der 1912 das γ-Hexachlorcyclohexan erstmals isoliert und beschrieben hatte. Die insektizide Wirkung von Hexachlorcyclohexan wurde 1935 entdeckt, anscheinend parallel bei der britischen Imperial Chemical Industries und durch den französischen Chemiker André Dupire, teilweise wird auch Marc Raucourt vom Agrarforschungszentrum in Versailles als Mitentdecker angegeben.[8] Seit 1942 wird Lindan als Insektizid eingesetzt. In der Schweiz verwendete man von 1946 an ein Hexachlorcyclohexan (HCH)-Isomerengemisch. Bald stellte sich heraus, dass Rüben, Kartoffeln und Kohl durch die Anwendung von HCH einen modrigen Geschmack bekamen, der sie ungenießbar machte. Da die Geschmacksbeeinträchtigung nicht vom γ-HCH, sondern von anderen HCH-Isomeren ausging, wurden Verfahren entwickelt, um reines Lindan zu isolieren. 1950 konnte in der Schweiz die Herstellung von Lindan aufgenommen werden. Die damals zuständigen eidgenössischen Versuchsanstalten zogen 1952 die Zulassungen für Pflanzenschutzmittel auf HCH-Basis zurück.[8]
Nach einem Höhepunkt um 1969 ging die Produktion von Lindan weltweit zurück.
In Deutschland darf Lindan seit 1980 nur mehr in Form von isomerenreinem Gamma-Hexachlorcyclohexan als Fraß- und Kontaktgift eingesetzt werden. Die früher mit ausgebrachten Alpha- und Beta-Isomere (CAS: 319-84-6, 319-85-7) erwiesen sich als toxischer und noch schwerer abbaubar als die ebenfalls nicht unproblematische Gamma-Struktur. Lindan wird seit 1984 in der BRD, seit 1989 in der damaligen DDR nicht mehr hergestellt, wird aber im Ausland noch verwendet. In den Staaten der EU und in der Schweiz sind keine Pflanzenschutzmittel mit diesem Wirkstoff zugelassen.[9]
Verwendung
Lindan wurde früher als Insektizid in der Land- und Forstwirtschaft eingesetzt, beispielsweise zur Bekämpfung von Engerlingen und gegen Schädlinge an Raps und Kohl.[8] Ein weiteres wichtiges Einsatzfeld waren die Holzschutzmittel, beispielsweise waren Lindan und PCP in den Holzschutzmitteln Xylamon BV und Xyladecor[10] enthalten. Daneben wird es in etwa einprozentiger Verdünnung in der Medizin als äußerliches Medikament gegen Hautparasiten, vornehmlich bei Krätze und Pedikulosen, genutzt. Nach der EU-Verordnung 850/2004 durfte Lindan nur noch bis Ende 2007 in der Europäischen Union als Insektizid eingesetzt werden.
Gefahrenpotential
Die Internationale Agentur für Krebsforschung (IARC) der WHO stufte Lindan im Jahr 2015 als „krebserregend bei Menschen“ (Gruppe 1) ein.[11]
Lindan neigt zu starker Adsorption, z. B. an Algen,[12] und ist für Wasserorganismen giftig. Da es nur langsam abgebaut wird und relativ stark lipophil ist, reichert es sich vor allem über Fische stark in der Nahrungskette des Menschen an.[13]Lindan darf daher ungebunden unter keinen Umständen in die Umwelt gelangen. Zusammen mit anderen Insektiziden auf Basis chlorierter Kohlenwasserstoffe wird Lindan auch als Mitauslöser der Parkinson-Krankheit diskutiert.[14]
Lindan steht ferner im Verdacht, bei Überschreitung der Normalwerte schwere Krankheiten auslösen zu können: Veränderung der inneren Organe, der Blutbildung, Multiple Sklerose, Nervenschädigungen. Betroffen sind nicht nur Landwirte, Handwerker und Chemiearbeiter, sondern auch Hausbewohner, die dem als Holzschutzmittel verwendeten Lindan über die Atemluft ausgesetzt sind. Einem Urteil des Oberlandesgerichts Nürnberg zufolge stellt Lindan eine nicht zu vernachlässigende Gesundheitsgefahr dar, wenn die Lindan-Konzentration im Blut 0,08–0,10 pg/l übersteige.
Altlasten
Es wird geschätzt, dass bei der Herstellung von Lindan während sechzig Jahren weltweit zwischen vier und sieben Millionen Tonnen an Abfall angefallen ist. Dieser besteht zu rund 80 % aus α-HCH und zu einem geringeren Anteil aus β-HCH. Ein Teil dieses Abfalls lagert in offenen Deponien.[15]
Im schleswig-holsteinischen Barsbüttel war eine ehemalige Deponie belastet. In der ehemaligen DDR sind große Teile der Mulde- und Elbeauen im Raum Bitterfeld/Dessau stark mit Lindan-Rückständen belastet.
Im Grenzgebiet bei Basel, Elsass (Département Haut-Rhin) und Weil/Lörrach (sogenanntes Dreyeckland) wurde eine unbekannte Menge aus 100.000 Tonnen Lindan-Produktionsrückständen der Firma Ugine-Kuhlmann (Huningue) unter anderem in Staubform als Beton-Zuschlagstoff „entsorgt“. Aufgrund der Geruchsbelästigung von der betroffenen Bevölkerung nicht als Straßenbelag akzeptiert, wurde der „HCH-Beton“ z. B. der örtlichen Landwirtschaft zur Befestigung von Feldwegen geschenkt; Proben weisen einen HCH-Gehalt von bis zu 75 % auf. Mittlerweile ist das HCH lokal in Grund- und Oberflächenwasser nachweisbar; trotz der nun 40-jährigen Verweildauer im Freien ist es immer noch geruchlich wahrnehmbar.[16]
Heute stellen mit Lindan behandelte Hölzer in vielen Gebäuden im Bestand ein ernstzunehmender Gebäudeschadstoff dar, der nicht selten aufwendig saniert werden muss.
Seite „Lindan“. In: Wikipedia, Die freie Enzyklopädie. Bearbeitungsstand: 4. Januar 2017, 05:36 UTC. URL: https://de.wikipedia.org/w/index.php?title=Lindan&oldid=161256138 (Abgerufen: 16. Mai 2017, 15:26 UTC)
Unterrichtsmitschrift vom 27.10.2016 - Leistungskurs Chemie 11
Die Entwicklung der FCKW-Gase 1930 wird als großer Sieg des technischen Fortschritts gefeiert. Die neuen Wundergase aus Fluorchlorkohlenwasserstoff sind vielfältig einsetzbar und alltagstauglich.
Mehr lesen unter:
http://programm.ard.de/TV/Programm/Jetzt-im-TV/?sendung=282057510667860
Fruehe.Warnung.spaete.Einsicht.6v8.FCKW.-.Unsichtbare.Ozonkiller1
Fruehe.Warnung.spaete.Einsicht.6v8.FCKW.-.Unsichtbare.Ozonkiller2
Fruehe.Warnung.spaete.Einsicht.6v8.FCKW.-.Unsichtbare.Ozonkiller3
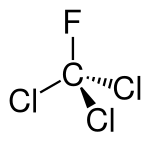
| Strukturformel | |
|---|---|
|
|
| Allgemeines | |
| Name | Trichlorfluormethan |
| Andere Namen |
|
| Summenformel | CCl3F |

Konzentration von Trichlorfluormethan in der Atmosphäre über die Zeit
Fluorchlorkohlenwasserstoffe
Fluorchlorkohlenwasserstoffe (FCKW, chemische Nomenklatur nach IUPAC: Chlorfluorkohlenwasserstoffe, CFKW, oder auch Freone[1]) sind eine umfangreiche chemische Gruppe niedermolekularer organischer
Verbindungen, die als Treibgase, Kältemittel oder Lösemittel verwendet werden. FCKW sind Kohlenwasserstoffe, bei denen Wasserstoffatome durch die Halogene Chlor und Fluor ersetzt wurden, sie sind eine Untergruppe der Halogenkohlenwasserstoffe. FCKW, die nur Einfachbindungen enthalten, nennt man gesättigte FCKW. Ist in der
Verbindung kein Wasserstoff mehr enthalten, so nennt man sie Chlorfluorkohlenstoffe.
Im Laufe der 1970er und 1980er Jahre stellte sich heraus, dass die Freisetzung von FCKW in die Atmosphäre in erheblichem Maße für den Abbau der Ozonschicht in der Stratosphäre („Ozonloch“) verantwortlich ist, weshalb der Einsatz von FCKW heute in
vielen Anwendungsbereichen verboten ist.
Mit H-FCKW werden „teilhalogenierte“ Fluorchlorkohlenwasserstoffe bezeichnet, ihre Wasserstoffatome sind nur teilweise durch Chlor- und Fluoratome ersetzt: Sie besitzen ein weitaus geringeres Ozonabbaupotenzial als die FCKW, ihr „Treibhauspotenzial“ liegt ebenfalls weit unter dem der FCKW. Zudem werden die H-FCKW schon in der Troposphäre abgebaut und gelangen nur teilweise in die Stratosphäre.
Eigenschaften
FCKW sind sehr beständig, unbrennbar, geruchlos, durchsichtig (farblos) und sind oft ungiftig oder haben nur eine geringe Toxizität.[1] Die FCKW der Methan- und Ethanreihe besitzen einen niedrigen Siedepunkt und lassen sich durch Komprimieren leicht verflüssigen. Da sie während des Verdampfens große Wärmemengen absorbieren können sind sie vor allem als Kühlmittel von Bedeutung (s.u.).[1] FCKW haben wegen ihrer Reaktionsträgheit eine hohe Verweildauer in der Atmosphäre. Sie steigen deshalb bis in die Stratosphäre auf und werden dort von den UV-Strahlen zerlegt. Dabei werden Chlor- bzw. Fluor-Radikale freigesetzt, welche mit dem Ozon der Ozonschicht reagieren und dieses schädigen. Im Jahr 1981 beschrieb Veerabhadran Ramanathan, dass allein der sehr starke Treibhauseffekt der Fluorchlorkohlenwasserstoffe die Erdatmosphäre bis zum Jahr 2000 um ein ganzes Grad erwärmen würde, wenn die Emissionen dieses Gases nicht dramatisch reduziert werden.[2]
2007 wurden drei FCKWs mit untypischen Eigenschaften – sehr reaktiv und giftig – in der Atmosphäre nachgewiesen.[3]
Seite „Fluorchlorkohlenwasserstoffe“. In: Wikipedia, Die freie Enzyklopädie. Bearbeitungsstand: 16. Oktober 2016, 12:15 UTC. URL: https://de.wikipedia.org/w/index.php?title=Fluorchlorkohlenwasserstoffe&oldid=158801347 (Abgerufen: 1. November 2016, 14:30 UTC)
Geschichte und Verwendung
Ende des 19. Jahrhunderts wurden die ersten halogenierten Kohlenwasserstoffe durch Direktfluorierung (Moissan) und elektrophil katalysierten Halogenaustausch (Swarts) hergestellt. Die ersten FCKW (CFCl3 und CF2Cl2) wurden 1929 durch Thomas Midgley bei General Motors synthetisiert. Ab 1930 wurden die FCKW technisch hergestellt und zunehmend als Kältemittel in Kältemaschinen, als Treibgas für Sprühdosen, als Treibmittel für Schaumstoffe, als Reinigungs- und Lösungsmittel eingesetzt. Der Einsatz als Kältemittel in Kühlschränken ist seit 1995 verboten, da FCKW zur Zerstörung der Ozonschicht beitragen.
Bromhaltige FCKW wurden als Feuerlöschmittel eingesetzt und werden auch als Halone bezeichnet.
Die Chemiker Harold D. Johnston, Paul Crutzen, F. Sherwood Rowland und Mario Molina entdeckten in den frühen 1970er Jahren den Radikalmechanismus, der u.a. FCKWs in reaktive Radikale überführt, die das Ozon in der Stratosphäre zerstören können. [1] Vor dem Einsatz von FCKW wurde erstmals 1974 gewarnt, doch dies wurde nicht ernst genommen. Die Entdeckung des Ozonlochs 1985 sorgte für einen Meinungswandel. Im Montrealer Protokoll vom 16. September 1987 verpflichteten sich viele Staaten zur drastischen Reduktion der Herstellung von FCKW. Am 29. Juni 1990 beschloss die internationale Konferenz zum Schutz der Ozonschicht in London (siehe auch Londoner Konferenz), die Herstellung und Anwendung von CFK und FCKW ab dem Jahr 2000 zu verbieten oder zumindest stark einzuschränken. Die Einigung sah vor, den FCKW-Einsatz bis 1995 um 50 %, bis 1997 um 85 % zu reduzieren. Die chemische Stabilität macht diese Gase in der Atmosphäre nur schwer abbaubar (mittlere Verweildauer je nach Produkt zwischen 44 und 180 Jahre).
Die wichtigsten FCKW-Kältemittel:
| Bezeichnung | Trivialname | Summenformel | Siedepunkt |
|---|---|---|---|
| Trichlorfluormethan | Frigen 11 | CCl3F | 24,9 °C |
| Dichlordifluormethan | Frigen 12 | CCl2F2 | −30 °C |
| Dichlorfluormethan | Frigen 21 | CHCl2F | 8,9 °C |
| Chlordifluormethan | Frigen 22 | CHClF2 | −40,7 °C |
| 1,1,2-Trichlor-1,2,2-trifluorethan | Frigen 113 | CClF2–CCl2F | 48 °C |
| 1,2-Dichlor-1,1,2,2-tetrafluorethan | Frigen 114 oder Cryofluoran | CClF2–CClF2 | 3,5 °C |
Umwelteinfluss
Die niedermolekularen, wasserstofffreien CFK gelangen aufgrund ihrer chemischen Stabilität und ihrer großen Flüchtigkeit in die Stratosphäre und reagieren mit der Ozonschicht. Beispiel:
Dabei bedeutet 

Das Chlorradikal baut Ozon zu biatomarem Sauerstoff ab. Das an dem Sauerstoff gebundene Chlor wird wieder frei, wobei molekulares Chlor entsteht. Durch ein Photon geeigneter Energie werden daraus wieder Chlorradikale freigesetzt, wodurch der Zyklus von vorn beginnen kann:[4]
Dadurch wird die Ozonschicht zerstört. Ohne deren Schutzwirkung kann harte UV-Strahlung bis zur Erdoberfläche dringen und Pflanzen, Tiere und Menschen schädigen.
FCKW absorbieren außerdem Sonnenstrahlung im Infrarotbereich (stärker als CO2) und tragen gemäß ihrem jeweiligen Treibhauspotenzial (in CO2-Äquivalent) unterschiedlich zur globalen Erwärmung bei. Einige FCKW übersteigen das Treibhauspotenzial von Kohlendioxid um das Zehntausendfache.
Alternativen
Alternativen zu den FCKW-basierten Treibgasen für Aerosol-Zerstäubung sind u. a. HFA-134a, das die Ozonschicht nicht beeinträchtigt, dafür aber den Treibhauseffekt fördert. Meistens wird jedoch ein durch Druck leicht zu verflüssigendes Alkangemisch aus Propan und Butan verwendet, weshalb diese Spraydosen das Gefahrensymbol hochentzündlich tragen. Bei den Kältemitteln bieten sich Propan, Butan, Pentan, Ammoniak, 2,3,3,3-Tetrafluorpropen oder Kohlenstoffdioxid sowie die chlorfreien Kältemittel wie R134a, R404a usw. als Alternativen an, wobei zu beachten ist, dass die ersten drei Substanzen feuergefährlich, Ammoniak und 2,3,3,3-Tetrafluorpropen ätzend und giftig sind.
Als Alternative für FCKW in der Elektronikindustrie bei der Herstellung von Flachbildschirmen, Solarzellen und Mikroschaltkreisen wurde Stickstofftrifluorid empfohlen, das seither eingesetzt wird. Neue Messverfahren wiesen 2008 dessen Konzentration in der Atmosphäre und die bedeutsame Klimaschädigung nach.[5]
Durch unsachgemäßes Recycling von Altkühlschränken in Deutschland gelangen (Stand 2008) noch immer große Mengen an FCKW in die Atmosphäre, während in Österreich beim Recycling weit mehr FCKW abgetrennt wird.[6]
Seite „Fluorchlorkohlenwasserstoffe“. In: Wikipedia, Die freie Enzyklopädie. Bearbeitungsstand: 16. Oktober 2016, 12:15 UTC. URL: https://de.wikipedia.org/w/index.php?title=Fluorchlorkohlenwasserstoffe&oldid=158801347 (Abgerufen: 1. November 2016, 14:30 UTC)
Unterrichtsmitschrift von Simon Müller (Lk Chemie 11) am 2.11.2016

Das Ozonloch schließt sich
http://www.balkanforum.info/f45/klimawandel-217429/index10.html
Ozonkonzentration von 1996 bis 2011
http://planeterde.de/Members/rduechting/pm-fotos/SCIAMACHY_1_HiRes_m.jpg/view
Ozonschicht über der Erde erholt sich
Filmtipps zum Thema "Ozon und FCKW"
Mittendrin 10 in einem Gewächshaus - Umweltmagazin mit Peter Lustig
https://www.youtube.com/watch?v=oVXydcYiuUg






