V95 silvermirrortest - Silberspiegelprobe
http://www.youtube.com/watch?v=h7bsVy2cm-8
Unter http://www.experimentalchemie.de/versuch-049.htm ist der Download
einer Filmsequenz zur Silberspiegelprobe moglich.
Unterrichtmitschrift von Simon Müller am 3.02.2016

Übung Redoxreaktionen - Tollens-/ Silberspiegel-Probe [Variante A]
Die Tollensprobe (benannt nach dem Agrikulturchemiker Bernhard Tollens) oder Silberspiegelprobe ist ein Nachweis für Aldehyde bzw. reduzierende funktionelle Gruppen.
Das Tollensreagenz ist eine ammoniakalische Silbernitrat-Lösung, welche man herstellt, indem man zu einer Silbernitrat-Lösung so lange konzentrierte Ammoniak-Lösung hinzutropft, bis der entstehende braune Niederschlag von Silber(I)-oxid (Ag2O) in den löslichen Diamminsilber(I)-komplex ([Ag(NH3)2]+) übergeht.
Zum Nachweis gibt man zu einer wässrigen Lösung der zu testenden Substanz im Reagenzglas die ammoniakalische Silbernitrat-Lösung und erwärmt diese im Wasserbad für wenige Minuten auf ca. 70 °C.
Der Nachweis ist positiv, wenn sich durch Fällung von elementarem Silber die Lösung schwarz verfärbt und sich an der Innenwand des Reagenzglases Silber abscheidet, was zur Bildung eines spiegelnden Belages führt.
Die Reaktionsgleichung für die Oxidation von Ethanal (Acetaldehyd) als Beispiel für einen reduzierenden Stoff mit ammoniakalischer Silbernitrat-Lösung zu Essigsäure lautet:
Die Tollensprobe – eine Redoxreaktion
Da die Oxidation der Probesubstanz durch Reduktion der Silber(I)-Ionen erfolgt, kann die Gesamtreaktion wie bei allen Redoxreaktionen in eine Oxidations- und Reduktionsreaktion zerlegt werden. Dabei wird im nachfolgenden Beispiel zur Vereinfachung nicht berücksichtigt, dass die Silberionen eigentlich in einem Silberdiamminkomplex vorliegen:
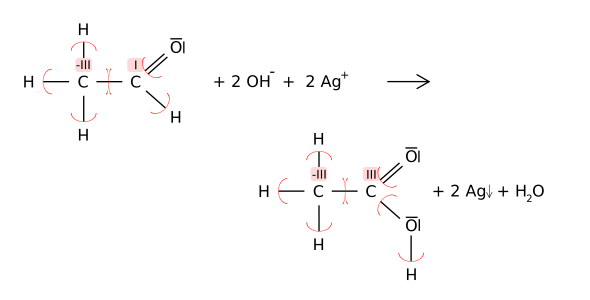
Die Redox-Reaktion lässt sich auch (hier am Kohlenstoff-Atom) mit Hilfe der Oxidationszahlen verfolgen:
Seite „Tollensprobe“. In: Wikipedia, Die freie Enzyklopädie. Bearbeitungsstand: 6. Januar 2017, 11:04 UTC. URL: https://de.wikipedia.org/w/index.php?title=Tollensprobe&oldid=161351435 (Abgerufen: 8. Februar 2017, 20:53 UTC)

![\mathrm{CH_3CHO + 2 \ [Ag(NH_3)_2]^+ + 2 \ OH^- \longrightarrow}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5138651644387d20108d16056a8d6d5568e801df)