Unterrichtsmitschrift von Simon Müller (CH 13) am 13.09.2018

Unterrichtsmitschrift vom 30.11.2017 von Sarah Schienmann (ch13)


Unterrichtsmischrift vom 04 12 2017 (Sarah Schienmann ch13)
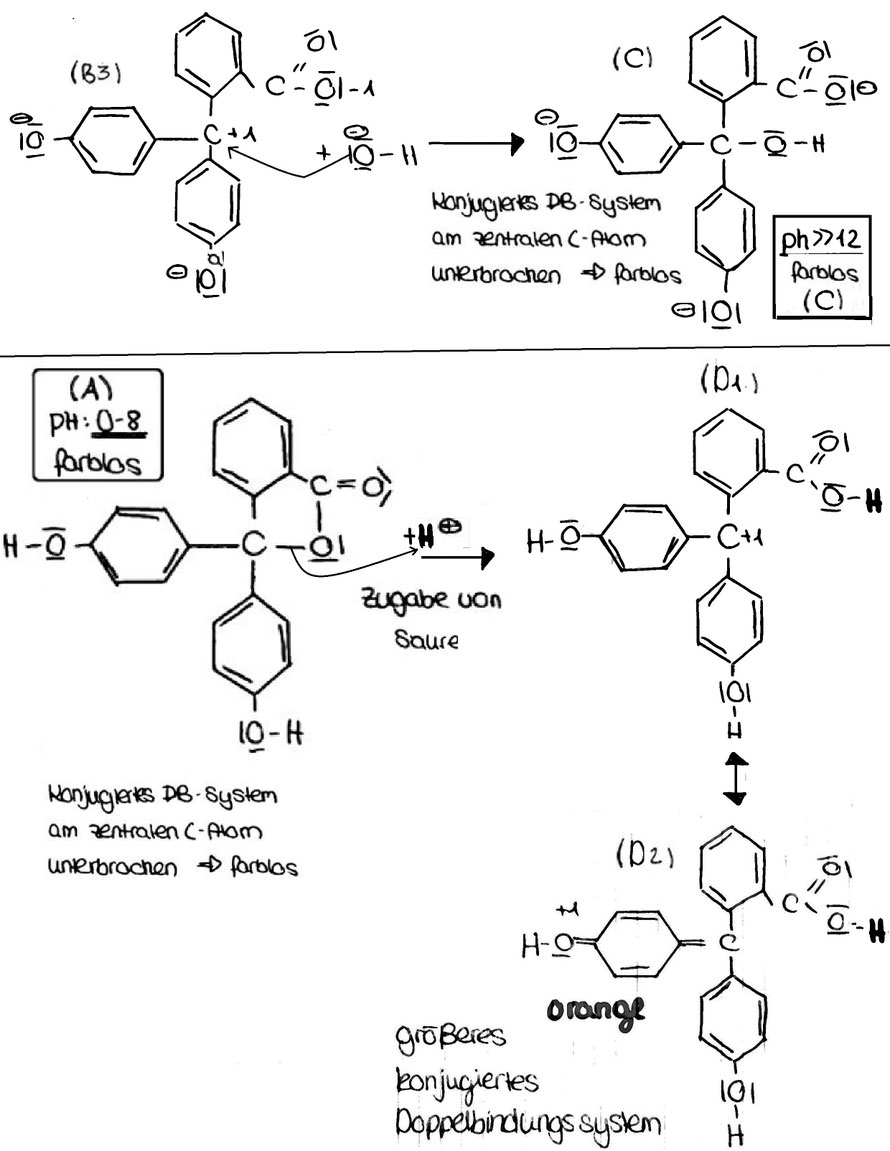
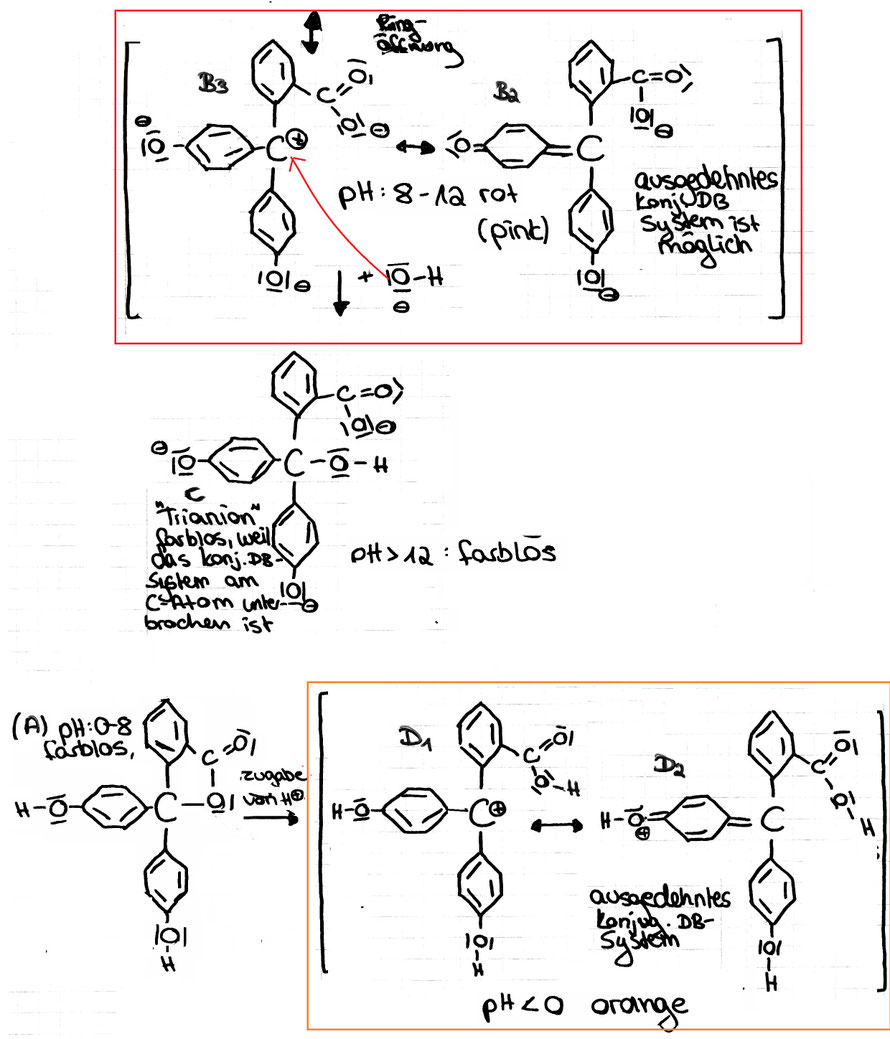
(A) Im pH-Bereich von 0 bis ca. 8 liegt es in seiner farblosen, ungeladenen Grundform vor (A in der Zeichnung).
Das konjugierte Doppelbindungssystem ist hier am zentralen C-Atom unterbrochen.
(B) In stärker basischer Lösung (pH 8 bis ca. 12) werden die Protonen an den beiden Hydroxylgruppen abgespalten (B1). Die Unterbrechung des konjugierten Doppelbindungssystems am zentralen
C-Atom ist nun aufgehoben. In einer möglichen mesomeren Grenzstruktur ein ausgedehntes konjugiertes Doppelbindungssystem mit 9 konjug. DB vorhanden (B2). Das ist die pink-farbige Struktur
des Indikators die in Mesomerie zur Struktur (B3) steht.
(C) In sehr stark basischer Umgebung lagert sich am zentralen Kohlenstoffatom ein OH--Ion an, Das konjugierte Doppelbindungssystem ist erneut am zentralen C-Atom unterbrochen. wodurch das Erreichen eines ausgedehnten konjugierten Doppelbindungssystems unmöglich wird: (C in der Zeichnung)
(D) In stark saurer Lösung wird Phenolphthalein wieder farbig. Der Lactonring wird durch das H+ gespalten. Dabei bildet sich eine positive Ladung am zentralen Kohlenstoffatom, Die Unterbrechung des konjugierten Doppelbindungssystems am zentralen C-Atom ist nun wieder aufgehoben (vgl. D1/2), wodurch erneut das Erreichen eines ausgedehnten konjugierten Doppelbindungssystems möglich ist.
Seite „Phenolphthalein“. In: Wikipedia, Die freie Enzyklopädie. Bearbeitungsstand: 1. Dezember 2017, 13:15 UTC. URL: https://de.wikipedia.org/w/index.php?title=Phenolphthalein&oldid=171567340 (Abgerufen: 29. Dezember 2017, 20:43 UTC)
Eigenschaften des Pheolphthaleins
Phenolphthalein ist ein weißes kristallines Pulver und in Wasser praktisch nicht löslich. Es findet meist in 1%iger alkoholischer Lösung Verwendung. Es ist selbst eine schwache Säure.
Phenolphthalein besitzt einen pKs-Wert von 9,7. Wenn man den Umschlagsbereich festlegt bei einem Indikatorsäure/-base-Verhältnis von 10:1 bis 1:10, erhält man nach der Henderson-Hasselbalch-Gleichung einen Umschlagbereich von pH = pKs ± 1 (8,7 bis 10,7). Bei einem pH-Wert von kleiner als 0 ist eine wässrige Phenolphthalein-Lösung rot-orange, bei einem pH-Wert von 0 bis etwa 8,2 farblos, bei höherem pH-Wert färbt die Lösung sich rosa-violett, im stark alkalischen Bereich – bei einem pH-Wert nahe 13 –, wird sie wieder farblos. Es ist daher beispielsweise bei der Titration basischer Lösungen gut als Indikator geeignet.
Seite „Phenolphthalein“. In: Wikipedia, Die freie Enzyklopädie. Bearbeitungsstand: 1. Dezember 2017, 13:15 UTC. URL: https://de.wikipedia.org/w/index.php?title=Phenolphthalein&oldid=171567340 (Abgerufen: 29. Dezember 2017, 20:43 UTC)
Fenolftaleína. EXPERIMENTOS
https://www.youtube.com/watch?v=izsJiGfXhZg
