Farbstoffe Kristallviolett als Indikator Stunde vom 05 11 2019 ch 13 MPEG
https://youtu.be/TSI09cywzsY

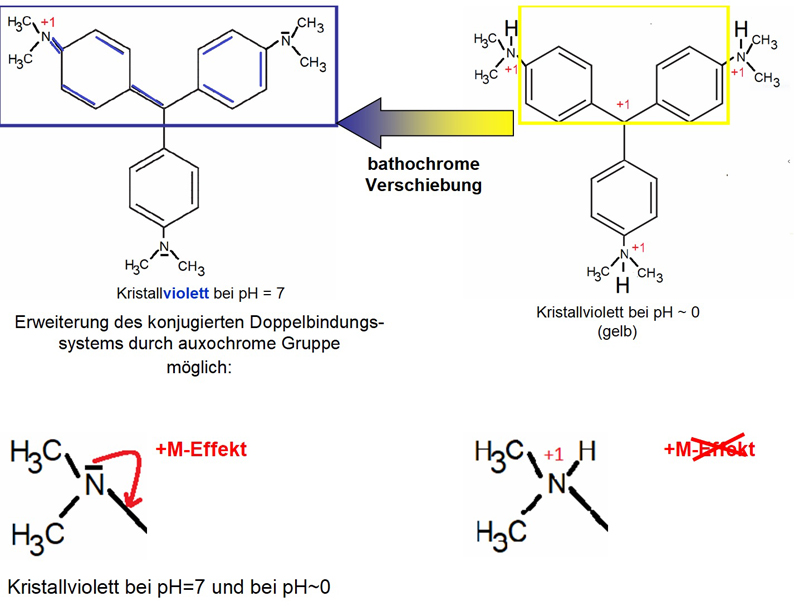
Farbe von Kristallviolett bei unterschiedlichen pH-Werten
Versuchsvorschrift:
A) 21 mg Kristallviolett werden in 1 Liter Wasser gelöst => Lösung A (neutral)
B) 400 ml Lösung A + 200ml NaOH (c=1mol/l) => Lösung B (alkalisch)
C) 400 ml Lösung A + 50 ml konz. HCL (37%ig) => Lösung C (sauer)
Vgl.: Kristallviolett - ein pH-Indikator
Siehe auch: http://www.bautschweb.de/chemie/kristallviolett/kristallviolett.htm
Unterrichtsmitschrift von Simon Müller (Chemie LK 13) am 14.09.2018



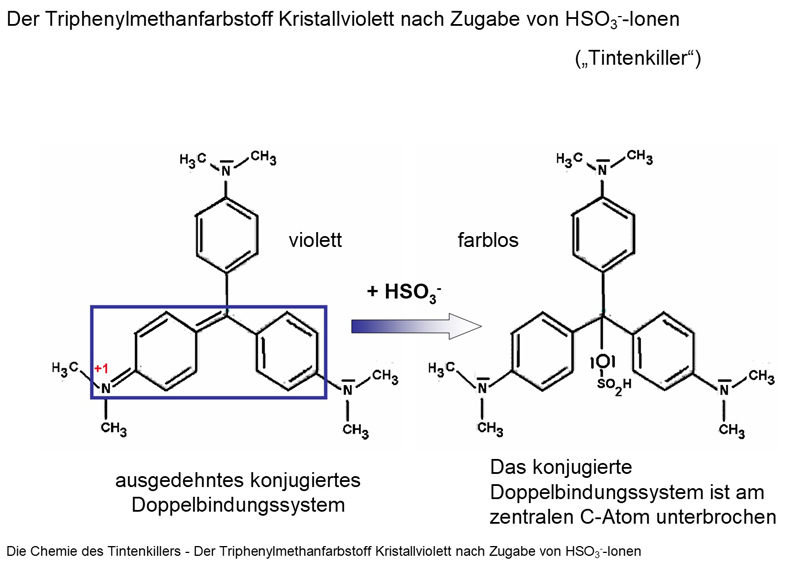
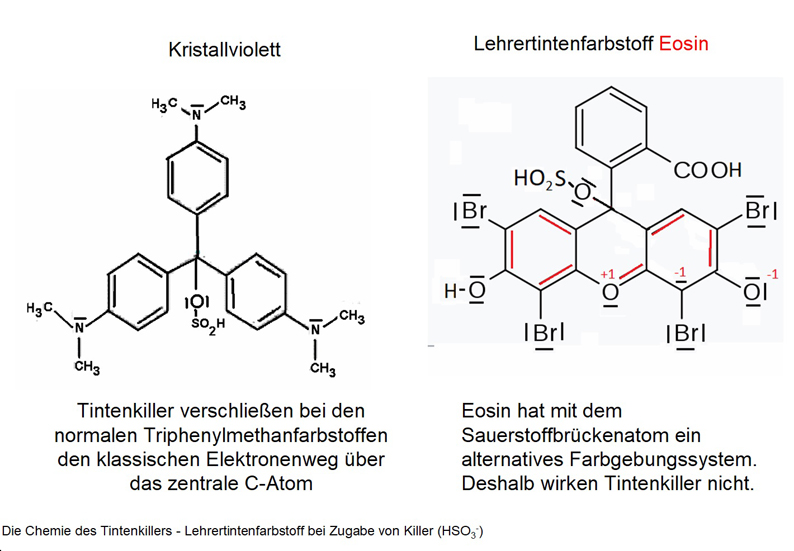
Die Chemie des Tintenkillers
Verwendete Quellen:
http://de.wikipedia.org/wiki/Tintenkiller Wikipedia-Artikel zum
Thema „Tintenkiller“
http://www.chemieunterricht.de/dc2/tip/09_03.htm
bzw.: http://www.chemieunterricht.de/dc2/tip/09_03-01.htm Die Seiten sind Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes
Bildungsserver für ChemieWie löscht ein Tintenkiller Tinte? https://www.basf.com/de/company/news-and-media/multimedia/podcasts.html
Der Download ist im Januar 2018 möglich unter. https://www.basf.com/documents/corp/de/news-and-media/multimedia/podcasts/09_BASF_Podcast_Reporter_de.mp3
Tintenlöscher
Ein Tintenlöscher oder Tintenlöschstift, ugs. auch Tintenkiller, kurz Killer, oder älter Tintentod genannt, ist ein Stift zur Vornahme von Korrekturen an mit meist nur blauer Tinte geschriebenen Texten. Regelmäßig besteht ein Tintenlöschstift aus zwei Teilen: Mit dem einen Ende kann die Tinte „unsichtbar“ gemacht, mit dem Filzstift am anderen Ende dann die Korrektur vorgenommen werden.
Geschichte
Bereits vor 1900 waren industriell hergestellte Mittel zum Entfernen von Tinte unter den Bezeichnungen Radierwasser und Tintentod allgemein bekannt und im Handel erhältlich.[1] Die ersten Exemplare im Handel enthielten die wirksame Substanz als gepressten Stift (ähnlich den Rasierstiften). Zum Gebrauch wurde dieser angefeuchtet und die Tinte damit gelöscht. Nachfolgende Produkte, etwa das unter der Marke Pelikan seit ca. 1930 vertriebene, aus zwei Fläschchen bestehende Set, enthielten die Wirksubstanz als Lösung. Dazu zählt auch der 1972 als Neuheit auf den Markt gekommene Stift Tinten-Killer als Warenzeichen der damaligen Firma Kreuzer in Bonn. Ein baugleiches Modell vertrieb später Pelikan als Tintentiger.
Wirkungsweise
Alle Tinten sind organische Farbstoffe. Sie besitzen einen Chromophor, einen Molekülteil mit frei beweglichen Elektronen, die durch Licht bestimmter Wellenlängenbereiche angeregt werden können. Das einfallende Licht wird daher in diesem Wellenlängenbereich absorbiert. Das Licht der anderen Wellenlängen wird reflektiert. Die Wellenlängenverteilung ändert sich also bei der (partiellen) Reflexion, wodurch das reflektierte Licht eine Farbe bekommt. Als blaue Füllertinte werden vor allem Triphenylmethanfarbstoffe wie Wasserblau eingesetzt.
Wird die Beweglichkeit der farbgebenden Elektronen gestört, verliert der Farbstoff seine Farbe. Im Fall der Triphenylmethanfarbstoffe reicht dazu häufig eine Beeinflussung des zentralen Kohlenstoffatoms, beispielsweise mit einem Nukleophil, aus.
Wirkstoffe
Es sind im Wesentlichen drei unterschiedliche Methoden für die Wirkung des Tintenlöschers bekannt:
- Löschen mit Sulfiten: Hierbei lagern sich OH−- und HSO3−-Ionen an das zentrale Kohlenstoffatom der Farbstoffe an. Hierzu eignen sich zum Beispiel Natriumsulfit (Na2SO3), Natriumhydrogensulfit (NaHSO3) oder Kaliumsulfit (K2SO3). Das Prinzip entspricht dem der Herstellung Fuchsinschwefliger Säure aus Fuchsin.
- Löschen mit Carbonaten: Eine andere, etwas weniger effektive Möglichkeit ist die Störung mit Carbonaten wie Natriumcarbonat (Na2CO3) oder Natriumhydrogencarbonat (NaHCO3). Hierbei lagern sich ebenfalls OH−-Ionen an das zentrale Kohlenstoffatom an.
- Löschen mit Thiosulfaten und Dithioniten: Neben einigen komplexeren Stoffen kommen auch Dithionite oder Thiosulfate (z. B. Na2S2O3) für Tintenkiller in Frage.
In der Praxis werden diese Reduktionsmittel noch durch andere Stoffe wie Alkohol oder Soda (z. B. durch das obige Natriumcarbonat) verstärkt.
Seite „Tintenlöscher“. In: Wikipedia, Die freie Enzyklopädie. Bearbeitungsstand: 9. Dezember 2017, 19:34 UTC. URL: https://de.wikipedia.org/w/index.php?title=Tintenl%C3%B6scher&oldid=171821320 (Abgerufen: 29. Dezember 2017, 21:26 UTC)






Der Tintenkiller wirft aus philosophischer Sicht ein Problem auf, auf das Mike Krüger in der RTL-Sendung "7 Tage - 7 Köpfe" aufmerksam gemacht hat: Wo eigentlich bleibt das gelöschte Wort?
Wie löscht ein Tintenkiller Tinte?
Der Download ist im Januar 2017 möglich unter.
https://www.basf.com/documents/corp/de/news-and-media/multimedia/podcasts/09_BASF_Podcast_Reporter_de.mp3


