Elektrolyse von Zinkbromid - YouTube
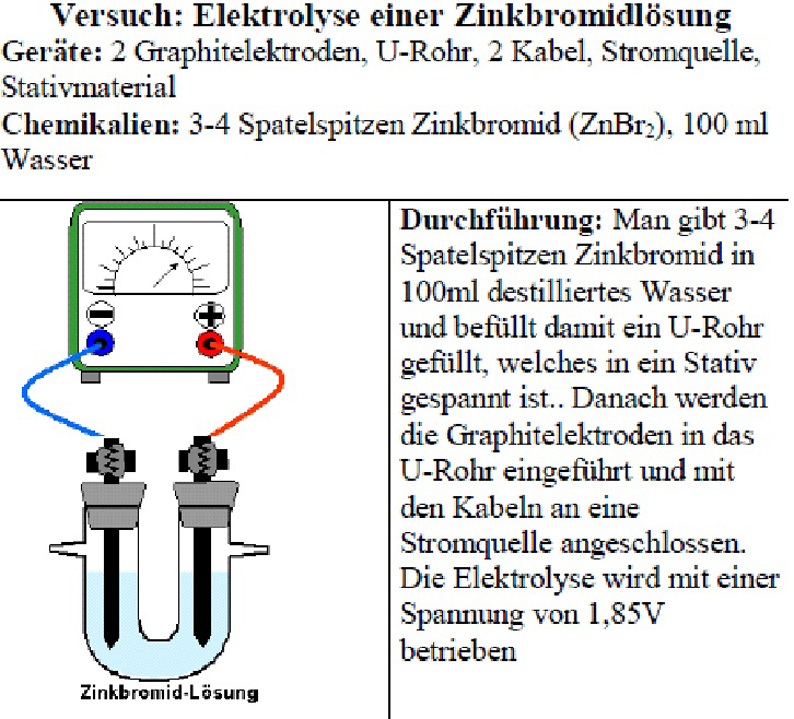
Unterrichtsmitschrift von Lilith Schmitt am 18.12.2017



Man kann die Elektrolyse von Zinkbromid beenden (indem man die Spannungsquelle gegen ein Messgerät austauscht).
Tut man dies, so beträgt die gemessene Spannung ca. 1,83 V. . Was ist passiert?
Bei der Elektrolyse hat sich Brom (Br2) und Zink (Zn) gebildet.
Das gebildete Zink (Zn) und das gebildete Brom (Br2) können nun freiwillig miteinander reagieren.
Es hat sich ein Galvanisches Element gebildet


In dieser Galvanischen Zelle laufen nun folgende Reaktionen ab:
Zn => Zn2+ + 2 e- (Anodenoxidation)
Br2 + 2 e- => 2 Br- (Kathodenreduktion)
In diesem "freiwilligen" Galvanischen Element laufen also die umgekehrten Vorgänge ab wie bei der "erzwungenen" Elektrolyse von Zinkbromid.
Sowohl für die Elektrolyse als auch für eine Galvanische Zelle gilt:
Anode = Elektrode, an der die Oxidation stattfindet.
Kathode = Elektrode, an der die Reduktion stattfindet.
ANODENOXIDATION und KATHODENREDUKTION
Für Galvanische Elemente gilt folgende Faustregel:
Alles, was schlecht ist, gehört zusammen:
Anodenoxidation (es ist schlecht, wenn Eisen oxidiert = rostet); die Anode ist der Minuspol, dies ist in der Regel das unedlere Metall, dazu gehört das negativere Redoxpotential und - bei Konzentrationselementen - die geringere Ionenkonzentration
Alles, was gut ist, gehört zusammen:
Kathodenreduktion (Ag* + e- => Ag ist gut für das Silber); die Kathode ist der Pluspol, dies ist in der Regel das edlere Metall, dazu gehört das positivere Redoxpotential und - bei Konzentrationselementen - die höhere Ionenkonzentration.
Ein wenig Verwirrung gibt um die Begriffe Pluspol und Minuspol.
Immer gilt: Am Pluspol herrscht Elektronenmangel, am Minuspol herrscht Elektronenüberschuss.
Betrachten wie eine Galvanische Zelle :
An einer Elektrode findet eine Anodenoxidation statt
Zn => Zn2+ + 2 e-
Diese Elektrode wird negativ aufgeladen, weil durch die Anodenoxidation ein Überschuss an negativ geladenen Elektronen entsteht. Für eine Galvanische Zelle gilt also: Minuspol = Anode (und folglich Pluspol = Kathode)
Betrachten wir die Elektrolyse von Zinkbromid, bei der die umkehrten Vorgänge stattfinden:
An einer Elektrode findet folgende Kathodenreduktion statt:
Zn2+ + 2 e- => Zn
Diese Kathodenreduktion, läuft nicht freiwillig ab, sondern wird dadurch erzwungen, dass man eine Spannung anlegt. Man erzwingt also, dass an ein einer Elektrode ein Elektronenüberschuss herrscht.
Für eine Elektrolyse gilt also: Minuspol = Kathode (und folglich Pluspol = Anode)
Sowohl für Elektrolysen als auch für Galvanische Zellen gilt:
Δ E = größere Zahl - kleinere Zahl
Δ E = E (Pluspol) - E (Minuspol)
Dies bedeutet für Galvanische Zellen:
Δ E = E (Kathode) - E (Anode)
Für eine Elektrolyse gilt::
Δ E = E (Anode) - E (Katode)
