Aus der Reihe ZDF-Studienprogramm Chemie
Folge Die Atmosphäre – ist sie für uns Luft?
https://www.youtube.com/watch?v=r1D7SYgDjZ8&list=PL662579395A3F083B&index=9 (Teil 01)
https://www.youtube.com/watch?v=DOydGgqMKmo&list=PL662579395A3F083B&index=10 (Teil 02)
Die Elektrolyse von Wasser am Ende von Teil 01 und Am Anfang von Teil 02 gezeigt
Filmtipp: Studienprogramm Chemie - Folge Die Atmosphäre – ist sie für uns Luft?
Der Download ist im internen Bereich dieser
Website möglich (passwortgeschützt)
Elektrolyse von Wasser (Ulrich Schütz)
https://www.youtube.com/watch?v=vAamppTMe04
Angesäuertes Wasser wird im Hofmannschen Wasserzersetzungsapparat mit Gleichstrom in 2 Teile Wasserstoff und 1 Teil Sauerstoff zerlegt. Die entstehenden Gase werden mit der Glimmspanprobe (Sauerstoff) und der Knallgasprobe (Wasserstoff) nachgewiesen. Wasser → Wasserstoff und Sauerstoff
Unterrichtsmitschrift von Lilith Schmitt am 18.12.2017

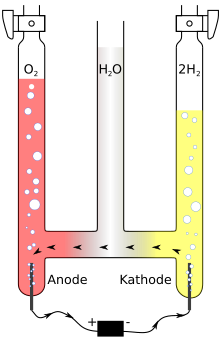
Hofmannscher Wasserzersetzungsapparat
Der Hofmannsche Wasserzersetzungsapparat, Hofmannsche Zersetzungsapparat oder Wasserzersetzungsapparat nach Hofmann ist ein Gerät zur Zerlegung von wässrigen Lösungen und wurde nach August Wilhelm Hofmann (1818–1892) benannt, der diesen Versuchsaufbau z. B. in seinem 1866 erschienenen Buch beschrieben hat.
Funktion
Er dient zur Demonstration der Zersetzung von Wasser. In diesem Fall wird die komplette Apparatur meistens mit verdünnter Schwefelsäure gefüllt, da reines Wasser keine ausreichende elektrische Leitfähigkeit besitzt. Nach dem Anlegen einer
Spannung an den Polen findet eine Gasentwicklung an Kathode und Anode statt.
Dabei wird das Wasser in seine beiden Bestandteile Sauerstoff und Wasserstoff zerlegt. Die entstehenden Gase sammeln sich in den beiden Messrohren und können mit Hilfe eines Hahns entnommen werden.
Das Verhältnis der Gasvolumina in den Schenkeln wird dabei 1 : 2 (Sauerstoff : Wasserstoff) betragen. Dieses Verhältnis kann allerdings nicht genau zustande kommen, da sich der Sauerstoff am Anfang besser im Wasser löst als Wasserstoff. Um dieses Problem zu umgehen, sollte der Versuch ein paar Minuten zuvor bei geöffneten Hähnen laufen.
Quelle: Seite „Hofmannscher Wasserzersetzungsapparat“. In: Wikipedia, Die freie Enzyklopädie. Bearbeitungsstand: 17. Dezember 2017, 18:19 UTC. URL: https://de.wikipedia.org/w/index.php?title=Hofmannscher_Wasserzersetzungsapparat&oldid=172057783 (Abgerufen: 13. Januar 2018, 20:43 UTC)
Exkurs: Basiskonzept „Donator-Akzeptor-Prinzip“
Bei Säure-Base-Reaktionen überträgt ein Protonendonator (eine „Brönstedt-Säure“) ein Proton (also ein H+-Ion) auf einen Protonenakzeptor) eine Brönstedt-Base.
Einige Beispiele:
a) Wasser reagiert mit der Säure HCl:
H2O + HCl → H3O+ + Cl-
b) Wasser reagiert mit der Base NH3:
H2O + NH3 → OH- + NH4+
c) Wasser (ein Ampholyt, also ein Stoff, der sowohl als Säure als auch als Base regieren kann) reagiert mit sich selbst - in einer „Autoprotolyse“-Reaktion):
H2O + H2O→ H3O+ + OH-
Eine Säure-Base-Reaktion läuft nach dem Donator-Akzeptor-Prinzip ab.
Das Donator-Akzeptor-Prinzip ist ein grundlegendes Prinzip bei chemischen Reaktionen.
Es werden Teilchen von einem Reaktionspartner (Donator) auf den anderen (Akzeptor) übertragen. Es handelt sich dabei um umkehrbare Reaktionen.
Bei Säure-Base-Reaktionen werden Protonen (H+-Ionen) übertragen.
Es sind aber auch aber auch Redoxreaktioen möglich:
Bei Redoxreaktionen werden Elektronen übertragen:
Die Abgabe von Elektronen – erkennbar an der Erhöhung der Oxidationzahl (OZ)
ist eine Oxidation.
Die Abgabe von Elektronen – erkennbar an der Erhöhung der OZ ist eine Reduktion.
Im Wasser (H2O, welches aufgrund der Autoprotolyse immer auch H3O+ und OH--Ionen enthält) können zahlreiche umkehrbare (!) Redoxreaktionen ablaufen. Es hilft ein Blick in eine Spannungsreihe. In der mathematisch-naturwissenschaftliche Formelsammlung des IQB findet sich die folgende Spannungsreihe:

Folgende Standardpotenziale sind für die Redoxreaktionen, die im Wasser ablaufen können, wichtig:
|
|
reduzierte Form |
<=> |
oxidierte Form |
|
A1 |
OZ(H) +I => 0 (bei pH = 14) Standardbedingungen => c(OH-) =1 mol/l |
|||||
|
|
H2 |
+ 2 OH- |
<=> |
2 H2O |
+ 2 e- |
-0,83V pH = 14 |
Die gleiche Reaktion (Änderung der OZ beachten!) lässt sich bei pH = 0 so formulieren:
|
A2 |
OZ(H) +I => 0 (bei pH = 0) Standardbedingungen => c(H3O+) =1 mol/l |
|||||
|
|
H2 |
+ 2 H2O |
<=> |
2 H3O+ |
+ 2 e- |
0,00V pH = 0 |
Die gleiche Reaktion (Änderung der OZ beachten!) lässt sich bei pH = 0 so formulieren:
|
B1 |
OZ (-II) => OZ 0 (bei pH = 14) => c(OH-) =1 mol/l |
|||||
|
|
4 OH- |
|
<=> |
O2 + 2 H2O |
+ 2 e- |
+0,40V pH = 14 |
Die gleiche Reaktion (Änderung der OZ beachten!) lässt sich bei pH = 0 so formulieren:
|
B2 |
OZ (-II) => OZ 0 (bei pH = 0) => c(H3O+) =1 mol/l |
|||||
|
|
6 H2O |
|
<=> |
O2 + 4 H3O+ |
+ 4 e- |
+1,23V pH = 0 |
Man erkennt: Im Wasser (H2O, aber auch H3O+ und OH-) können viele umkehrbare Redoxreaktionen ablaufen, z. B.:
- H2O oder H3O+ reagiert zu H2
(Die OZ von H erniedrigt sich von +I nach 0; vgl. A1 und A2)
- H2O oder OH- reagiert zu O2
(Die OZ von O erhöht sich von –II nach 0; vgl. B2 und B1)
Die Redoxchemie des Wassers ist kompliziert!
Ob eine solche Redoxreaktion abläuft, ist von vielen Faktoren abhängig:
a) Handelt es sich um eine Galvanische Zelle oder eine Elektrolyse?
b) Welcher pH-Wert liegt vor?
c) Welche Reaktionspartner liegen vor? Wo stehen sie in der elektrochemischen Spannungsreihe; und in welcher Konzentration sind sie vorhanden?
d) Das Aufstellen der Gleichungen für die ablaufenden Redoxreaktionen ist nicht einfach! Damit eine Reaktionsgleichung richtig ist, müssen folgende Bedingungen erfüllt sein:
1. Die Stoffbilanz muss stimmen. Wenn man auf der rechten Seite einer Gleichung z. B. zwei O-Atome findet, dann müssen es auch links zwei O-Atome sein.
2. Die Ladungsbilanz muss stimmen. Wenn man auf der rechten Seite der Gleichung z. B. vier negative Ladungen findet, dann müssen es auch auf der linken Seite der Gleichung vier negative Ladungen sein.
Um eine Redoxgleichung richtig aufzustellen, formuliert man getrennte Teilgleichungen für die Oxidation und für die Reduktion. Bei dem Aufstellen der Teilgleichungen geht man dabei in mehreren Schritten vor: Im ersten Schritt bestimmt man die Oxidationszahlen und ermittelt die Anzahl der übertragenen Elektronen. Im zweiten Schritt sorgt man für den Ausgleich der Ladungsbilanz, im dritten Schritt gleicht man die Stoffbilanz aus.
Die auf diese Weise ermittelten Teilgleichungen für die Oxidation und die Reduktion müssen in einem vierten Schritt dann noch zu einer Gesamtgleichung zusammengefasst werden.
Bei der Elektrolyse von Wasser im Hoffmann`schen Zersetzungsapparat (bei pH-Werten bis 7) bildet sich am Minuspol Wasserstoffgas H2. Aus H2O wird H2.
Stellen wir die Teilgleichung für diese Reaktion auf.
1. Schritt: Bestimmung der OZ und Ermittlung der Anzahl der übertragenen Elektronen
● Im H2O hat das H-Atom die OZ +I. Im H2 hat das H-Atom die OZ 0:
|
+I |
|
|
|
0 |
|
|
H2O |
|
|
→ |
H2 |
|
● Bei dem Atom, bei dem sich OZ sich ändert, muss von Beginn an die Stoffbilanz stimmen.
● Da wir auf der rechten Seite (im H2) und auf der linken Seite jeweils 2 H-Atome haben, stimmt diese vorläufige Stoffbilanz!
● Die Oxidationszahl des H wird im Verlauf der Reaktion von +I auf 0 erniedrigt.
● Eine Erniedrigung der OZ ist eine Reduktion, also eine Aufnahme von Elektronen.
● Elektronenaufnahme (bzw. Reduktion) bedeutet: Die Elektronen stehen auf der linken Seite der Reaktionsgleichung.
● Die Anzahl der übertragenen Elektronen kann man aus der Differenz der OZ berechnen:
- Um 1 H-Atom der OZ +I auf die OZ 0 zu reduzieren, braucht man 1 e-.
- Um 2 H-Atome der OZ +I auf die OZ 0 zu reduzieren, braucht man 2 e-.
● Wir schreiben also 2 e- auf die rechte Seite der Gleichung:
|
+I |
|
|
|
0 |
|
|
H2O |
+ 2e- |
|
→ |
H2 |
|
2. Schritt: Ausgleich der Ladungsbilanz (Ladungsausgleich) durch H3O+-Ionen
● Da wir uns im sauren bzw. neutralen Bereich (pH-Werte bis 7) befinden, erfolgt der Ausgleich der Ladungsbilanz (Ladungsausgleich) durch H3O+-Ionen. Würde der pH-Wert im alkalischen Bereich (pH > 7) liegen, so müsste der der Ladungsausgleich durch OH- -Ionen (die im alkalischen Bereich dominieren) erfolgen.
● „Ladungsausgleich durch H3O+“ bedeutet vereinfacht gesagt: Wir geben eine bestimmte Anzahl von H3O+-Ionen auf eine bestimmte Seite. Nach dem Ladungsausgleich muss die Ladungsbilanz stimmen, die Ladungen sollten dann auf beiden Seiten gleich sein!
● Wir sehen, dass wir auf rechten Seite der Gleichung zwei Elektronen (2e-) und wir damit zwei negative Ladungen haben.
● Um diese Ladungen auszugleichen, fügen wir auf der linken Seite 2 H3O+-Ionen hinzu:
|
:+I |
|
|
|
0 |
|
|
H2O |
+ 2e- |
+ 2 H3O+ |
→ |
H2 |
|
Wir haben nun auf der linken Seite und auf der auf der rechten Seite die Ladung 2+!
3. Schritt: Ausgleich der Stoffbilanz durch H2O-Moleküle
● Am Ende gleichen wir die Stoffbilanz durch H2O-Moleküle aus.
Ein Ausgleich der Stoffbilanz bedeutet: Wir geben eine bestimmte Anzahl von H2O-Molekülen auf eine bestimmte Seite und nach diesem Ladungsausgleich muss die Stoffbilanz stimmen; die Anzahl der Atome sollte dann auf beiden Seiten gleich sein!
● Wir sehen, dass sich auf der linken Seite der Gleichung 3 O-Atome (H2O + 2 H3O+) befinden und auf der rechten Seite der Gleichung kein O-Atom. Deshalb fügen wir zum Ausgleich der Stoffbilanz 3 H2O-Moleküle rechts hinzu.
|
+I |
|
|
|
0 |
|
|
H2O |
+ 2e- |
+ 2 H3O+ |
→ |
H2 |
+ 3 H2O |
Wir können ein H2O-Molekül auf beiden Seiten wegstreichen. Die Gleichung für die Anodenoxidation bei der Elektrolyse von Wasser im sauren Milieu lautet:
|
|
2e- + |
2 H3O+ |
→ |
H2 |
+ 2 H2O |
|
|
bzw.: |
2e- + |
2 H+ |
→ |
H2 |
bei Ladungausgleich mit H+ |
|
Einen dazu passenden Eintrag finden wir auch in der Spannungsreihe:
|
|
OZ(H) +I => 0 (bei pH = 0) Normalbedingungen |
|||||
|
|
H2 |
+ 2 H2O |
<=> |
2 H3O+ |
+ 2 e- |
0,00V pH = 0 |
Nur ein Gedankenexperiment: Was wäre, wenn die Reaktion von H2O zu H2 im alkalischen Bereich abliefe?
Stellen wir die Teilgleichung für diese Reaktion auf.
1. Schritt: Bestimmung der OZ und Ermittlung der Anzahl der übertragenen Elektronen
● Im H2O hat das H-Atom die OZ +I. Im H2 hat das H-Atom die OZ 0:
|
+I |
|
|
|
0 |
|
|
H2O |
|
|
→ |
H2 |
|
● Bei dem Atom, bei dem sich OZ sich ändert, muss von Beginn an die Stoffbilanz stimmen.
● Da wir auf der rechten Seite (im H2) und auf der linken Seite jeweils 2 H-Atome haben, stimmt diese vorläufige Stoffbilanz!
● Die Oxidationszahl des H wird im Verlauf der Reaktion von +I auf 0 erniedrigt.
● Eine Erniedrigung der OZ ist eine Reduktion, also eine Aufnahme von Elektronen.
● Elektronenaufnahme (bzw. Reduktion) bedeutet: Die Elektronen stehen auf der linken Seite der Reaktionsgleichung.
● Die Anzahl der übertragenen Elektronen kann man aus der Differenz der OZ berechnen:
- Um 1 H-Atom der OZ +I auf die OZ 0 zu reduzieren, braucht man 1 e-.
- Um 2 H-Atome der OZ +I auf die OZ 0 zu reduzieren, braucht man 2 e-.
● Wir schreiben also 2 e- auf die rechte Seite der Gleichung:
|
+I |
|
|
|
0 |
|
|
H2O |
+ 2e- |
|
→ |
H2 |
|
2. Schritt: Ausgleich der Ladungsbilanz (Ladungsausgleich) durch OH--Ionen
● Da wir uns im alkalischen Bereich (pH-Werte > 7) befinden, erfolgt der Ausgleich der Ladungsbilanz (Ladungsausgleich) durch OH--Ionen (die im alkalischen Bereich dominieren).
● „Ladungsausgleich durch OH-“ bedeutet vereinfacht gesagt: Wir geben eine bestimmte Anzahl von OH--Ionen auf eine bestimmte Seite. Nach dem Ladungsausgleich muss die Ladungsbilanz stimmen, die Ladungen sollten dann auf beiden Seiten gleich sein!
● Wir sehen, dass wir auf rechten Seite der Gleichung zwei Elektronen (2e-) und wir damit zwei negative Ladungen haben.
● Um diese Ladungen auszugleichen, fügen wir auf der rechten Seite 2 OH--Ionen hinzu:
|
+I |
|
|
|
0 |
|
|
H2O |
+ 2e- |
|
→ |
H2 |
+ 2 OH- |
Wir haben nun auf der linken Seite und auf der auf der rechten Seite die Ladung 2-!
3. Schritt: Ausgleich der Stoffbilanz durch H2O-Moleküle
● Am Ende gleichen wir die Stoffbilanz durch H2O-Moleküle aus.
Ein Ausgleich der Stoffbilanz bedeutet: Wir geben eine bestimmte Anzahl von H2O-Molekülen auf eine bestimmte Seite und nach diesem Ladungsausgleich muss die Stoffbilanz stimmen; die Anzahl der Atome sollte dann auf beiden Seiten gleich sein!
● Wir sehen, dass sich auf der linken Seite der Gleichung 1 O-Atom (H2O) befindet und auf der rechten Seite der Gleichung zwei O-Atome (2 OH-). Deshalb fügen wir zum Ausgleich der Stoffbilanz 1 H2O-Moleküle links hinzu.
|
+I |
|
|
|
0 |
|
|
H2O |
+ 2e- |
+ H2O |
→ |
H2 |
+ 2 OH- |
Die Gleichung für die Anodenoxidation bei der Elektrolyse von Wasser im alkalischen Milieu lautet:
|
|
2e- + |
2 H2O |
→ |
H2 |
+ 2 OH- |
Einen dazu passenden Eintrag finden wir auch in der Spannungsreihe:
|
|
OZ(H) +I => 0 (bei pH = 14) |
|||||
|
|
H2 |
+ 2 OH- |
<=> |
2 H2O |
+ 2 e- |
-0,83V pH = 14 |
Bei der Elektrolyse von Wasser im Hoffmann`schen Zersetzungsapparat (bei pH-Werten bis 7) bildet sich am Minuspol Sauerstoffgas O2. Aus H2O wird O2.
1. Schritt: Bestimmung der OZ und Ermittlung der Anzahl der übertragenen Elektronen
● Im H2O hat das O-Atom die OZ –II, im O2 hat das O-Atom die OZ 0.
|
-II |
|
|
|
0 |
|
|
|
H2O |
|
|
→ |
O2 |
|
|
● Bei dem Atom, bei dem sich OZ sich ändert, muss von Beginn an die Stoffbilanz stimmen.
● Da wir auf der rechten Seite (im O2) zwei O-Atome haben, brauchen wir auch links zwei O-Atome. Wir schreiben auf der linken Seite der Gleichung die Zahl 2 vor die Formel H2O:
|
-II |
|
|
|
0 |
|
|
|
2 H2O |
|
|
→ |
O2 |
|
|
● Die Oxidationszahl des O wird im Verlauf der Reaktion von –II auf 0 erhöht.
● Eine Erhöhung der OZ ist eine Oxidation, also eine Abgabe von Elektronen.
● Elektronenabgabe (bzw. Oxidation) bedeutet: Die Elektronen stehen auf der rechten Seite.
● Die Anzahl der übertragenen Elektronen kann man aus der Differenz der OZ berechnen:
- Wenn man 1 O-Atom der OZ –II auf die OZ 0 erhöht, entstehen 2 e-.
- Wenn man 2 O-Atome der OZ –II auf die OZ 0 erhöht, entstehen 4 e-.
● Wir schreiben also 4 e- auf die rechte Seite der Gleichung:
|
-II |
|
|
|
0 |
|
|
|
2 H2O |
|
|
→ |
O2 |
+4e- |
|
2. Schritt: Ausgleich der Ladungsbilanz (Ladungsausgleich) durch H3O+-Ionen
● Da wir uns im sauren bzw. neutralen Bereich (pH-Werte bis 7) befinden, erfolgt der Ausgleich der Ladungsbilanz (Ladungsausgleich) durch H3O+-Ionen.
● Ladungsausgleich durch H3O+ bedeutet vereinfacht gesagt: Wir geben eine bestimmte Anzahl von H3O+-Ionen auf eine bestimmte Seite. Nach dem Ladungsausgleich muss die Ladungsbilanz stimmen, die Ladungen sollten dann auf beiden Seiten gleich sein!
● Wir sehen, dass wir auf rechten Seite der Gleichung vier Elektronen (4e-) und damit vier negative Ladungen haben.
● Um diese Ladungen auszugleichen, fügen wir auf der rechten Seite 4 H3O+-Ionen hinzu:
|
-II |
|
|
|
0 |
|
|
|
2 H2O |
|
|
→ |
O2 |
+4e- |
+ 4 H3O+ |
Wir haben nun auf der linken Seite die Ladung 0 und auf der rechten Seite die Ladung 0!
3. Schritt: Ausgleich der Stoffbilanz durch H2O-Moleküle
● Am Ende gleichen wir die Stoffbilanz durch H2O-Moleküle aus. Ausgleich der Stoffbilanz bedeutet: Wir geben eine bestimmte Anzahl von H2O-Molekülen auf eine bestimmte Seite und nach diesem Ladungsausgleich muss die Stoffbilanz stimmen; die Anzahl der Atome sollte dann auf beiden Seiten gleich sein!
● Wir sehen, dass sich auf der rechten Seite der Gleichung 6 O-Atome (O2 + 4 H3O+) befinden und auf der linken Seite der Gleichung nur 2 Atome (2 H2O). Deshalb fügen wir zum Ausgleich der Stoffbilanz 4 H2O-Moleküle links hinzu.
Die Gleichung für die Kathodenreduktion bei der Elektrolyse von Wasser im sauren Milieu lautet:
|
-II |
|
|
|
0 |
|
|
|
2 H2O |
+ 4 H2O |
|
→ |
O2 |
+4e- |
+ 4 H3O+ |
|
6 H2O |
|
|
→ |
O2 |
+4e- |
+ 4 H3O+ |
Bei Ladungsausgleich mit H+ würde die Gleichung lauten:
|
2H2O |
|
|
→ |
O2 |
+4e- |
+ 4 H+ |
Einen dazu passenden Eintrag finden wir auch in der Spannungsreihe:
|
|
OZ (-II) => OZ 0 (bei pH = 0) |
|||||
|
|
6 H2O |
|
<=> |
O2 +4 H3O+ |
+ 4 e- |
+1,23V pH = 0 |
Nur ein Gedankenexperiment: Was wäre, wenn die Reduktion H2O zu O2 im alkalischen Bereich abliefe?
1. Schritt: Bestimmung der OZ und Ermittlung der Anzahl der übertragenen Elektronen
● Im H2O hat das O-Atom die OZ –II, im O2 hat das O-Atom die OZ 0.
|
-II |
|
|
|
0 |
|
|
|
H2O |
|
|
→ |
O2 |
|
|
● Bei dem Atom, bei dem sich OZ sich ändert, muss von Beginn an die Stoffbilanz stimmen.
● Da wir auf der rechten Seite (im O2) zwei O-Atome haben, brauchen wir auch links zwei O-Atome. Wir schreiben auf der linken Seite der Gleichung die Zahl 2 vor die Formel H2O:
|
-II |
|
|
|
0 |
|
|
|
2 H2O |
|
|
→ |
O2 |
|
|
● Die Oxidationszahl des O wird im Verlauf der Reaktion von –II auf 0 erhöht.
● Eine Erhöhung der OZ ist eine Oxidation, also eine Abgabe von Elektronen.
● Elektronenabgabe (bzw. Oxidation) bedeutet: Die Elektronen stehen auf der rechten Seite.
● Die Anzahl der übertragenen Elektronen kann man aus der Differenz der OZ berechnen:
- Wenn man 1 O-Atom der OZ –II auf die OZ 0 erhöht, entstehen 2 e-.
- Wenn man 2 O-Atome der OZ –II auf die OZ 0 erhöht, entstehen 4 e-.
● Wir schreiben also 4 e- auf die rechte Seite der Gleichung:
|
-II |
|
|
|
0 |
|
|
|
2 H2O |
|
|
→ |
O2 |
+4e- |
|
2. Schritt: Ausgleich der Ladungsbilanz (Ladungsausgleich) durch OH--Ionen
● Da wir uns im alkalischen (pH-Werte > 7) befinden, erfolgt der Ausgleich der Ladungsbilanz (Ladungsausgleich) durch OH--Ionen.
● Ladungsausgleich durch OH- bedeutet vereinfacht gesagt: Wir geben eine bestimmte Anzahl von H3O+-Ionen auf eine bestimmte Seite. Nach dem Ladungsausgleich muss die Ladungsbilanz stimmen, die Ladungen sollten dann auf beiden Seiten gleich sein!
● Wir sehen, dass wir auf rechten Seite der Gleichung vier Elektronen (4e-) und damit vier negative Ladungen haben.
● Um diese Ladungen auszugleichen, fügen wir auf der linken Seite 4 OH--Ionen hinzu:
|
-II |
|
|
|
0 |
|
|
|
2 H2O |
+ 4 OH- |
|
→ |
O2 |
+4e- |
|
Wir haben nun auf der linken Seite die Ladung 0 und auf der rechten Seite die Ladung 4-!
3. Schritt: Ausgleich der Stoffbilanz durch H2O-Moleküle
● Am Ende gleichen wir die Stoffbilanz durch H2O-Moleküle aus. Ausgleich der Stoffbilanz bedeutet: Wir geben eine bestimmte Anzahl von H2O-Molekülen auf eine bestimmte Seite und nach diesem Ladungsausgleich muss die Stoffbilanz stimmen; die Anzahl der Atome sollte dann auf beiden Seiten gleich sein!
● Wir sehen, dass sich auf der linken Seite der Gleichung 6 O-Atome (2H2O + 4 OH+-) befinden und auf der rechten Seite der Gleichung nur 2 Atome (O2). Deshalb fügen wir zum Ausgleich der Stoffbilanz 4 H2O-Moleküle rechts hinzu.
Die Gleichung für die Kathodenreduktion bei der Elektrolyse von Wasser im alkalischen Milieu lautet:
|
-II |
|
|
|
0 |
|
|
|
2 H2O |
+ 4 OH- |
|
→ |
O2 |
+4e- |
+ 4 H2O |
|
|
4 OH- |
|
→ |
O2 |
+4e- |
+ 2 H2O |
Einen dazu passenden Eintrag finden wir auch in der Spannungsreihe:
|
|
OZ (-II) => OZ 0 (bei pH = 14) Normalbedingungen |
|||||
|
|
4 OH- |
|
<=> |
O2 + 2 H2O |
+ 2 e- |
+0,40V pH= 14 |
Fassen wir zusammen:
Bei der Elektrolyse von Wasser im Hoffmann`schen Zersetzungsapparat (bei pH-Werten bis 7) laufen folgende Reaktionen ab:
Anodenoxidation am Pluspol der Elektrolyse:
|
|
2e- + |
2 H3O+ |
→ |
H2 |
+ 2 H2O |∙2 |
Kathodenreduktion am Minuspol der Elektrolyse:
|
6 H2O |
|
|
→ |
O2 |
+4e- |
+ 4 H3O+ |
Gesamtleichung:
4e- + 4 H3O+ + 6 H2O → 2 H2 + 4 H2O + O2 +4e-+ 4 H3O+
=> 2 H2O → 2 H2 + O2