Unterrichtsmitschrift von Simon Müller am 18 01 2018 - Ch 12
Unterrichtsvorschrift in Anlehnung an: http://www.axel-schunk.de/experiment/edm0206.html
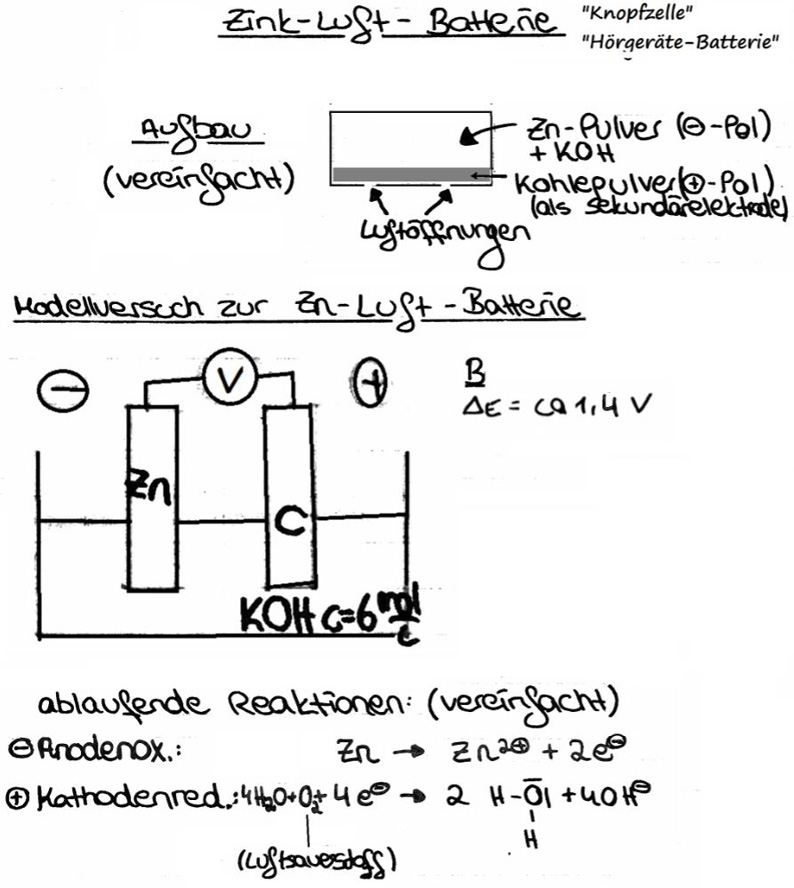
Handelsübliche Zink-Luft-Batterien

Aufbau einer Zink-Luft-Batterie:

In der Zink-Luft-Batterie wird Zink mit Luftsauerstoff in einem alkalischen Elektrolyten zum Oxid oder Hydroxid oxidiert und die dabei freiwerdende Energie elektrochemisch genutzt. Es laufen die folgenden Reaktionen ab:
| Gleichung[2] | |
|---|---|
| Anode |
 [3] [3]Oxidation / Elektronenabgabe |
| Elektrolyt |

|
| Kathode |
 [4] [4]Reduktion / Elektronenaufnahme |
| Gesamtreaktion |
 Redoxreaktion / Zellreaktion |
Eine Wiederaufladbarkeit kann erreicht werden, wenn das umgesetzte Metall mechanisch ersetzt wird, womit eine Variante einer Brennstoffzelle mit festem Brennstoff vorliegt. Solche Systeme werden seit den 1970er Jahren auf ihre Eignung in Elektrofahrzeugen geprüft, haben sich bisher jedoch noch nicht bewähren können.
