Chemie für Biologen
Stunde 02: Atome bestehen aus Elementarbaustenen
1. Atome bestehen aus kleineren Elementarbausteinen
In der letzten Stunde sagten wir, dass Elemente aus einer einzigen Atomsorte bestehen. Der Name „Atom“ kommt aus dem Griechischen und bedeutet so viel wie „unteilbares Teilchen“. Der Philosoph Demokrit, der im 4. Jahrhundert vor Chr. lebte, glaubte, das alle Stoffe aus solchen Atomen aufgebaut sind. Erst seit ca. 1880 wissen wir von den Physiken: Die Atome eines Elementes bestehen aus kleineren Bausteinen, den so genannten Elementarbausteinen.
Bsp.: Schauen wir uns ein Helium-Atom genauer an:
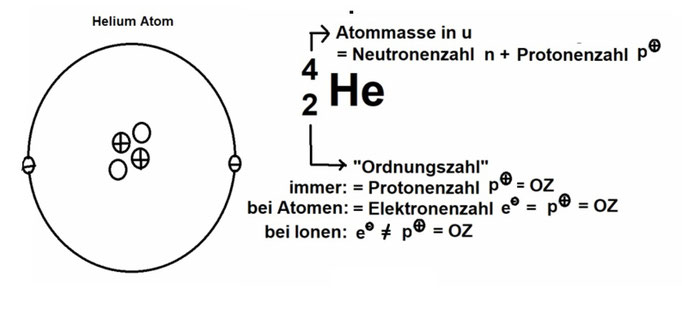
Man unterscheidet:
1.1. positiv geladene Protonen (p+), die sich im Atomkern befinden und die darüber entscheiden, um welches Element es sich handelt.
Alle H- Atome haben 1 Proton im Atomkern
Alle C- Atome
haben 6 Protonen im Atomkern
Alle O- Atome haben 8 Protonen im Atomkern
Alle N-Atome haben 7 Protonen im Atomkern
Die Protonenzahlen muss man nicht auswendig lernen: Sie finden sich in jedem Periodensystem der Elemente (PSE) als „Ordnungszahl“, die so etwas wie die „Platznummer“ jedes Elementes ist.
Die Protonenzahl entspricht immer der Ordnungszahl (OZ) des Elementes im Periodensystem der Elemente (PSE)!
Immer gilt also: Protonenzahl = OZ
Ein Proton wiegt 1 u, wobei u die atomare Masseneinheit ist, in der man die Masse von Atomen angibt. Es gilt:
1 u = 1,66 . 10-24 g
also
0.000 000 000 000 000 000 000 00166 g
<= 24 Nullen =>
1.2. Negativ geladene
Elektronen (e-), die sich in der Atomhülle befinden und die über die
chemischen Eigenschaften eines Elementes entscheiden. Elektronen sind vergleichsweise leicht. Ein Elektron wiegt ca. 1/2000 u.
Elektronen wiegen im
Vergleich zu den Protonen (Masse: 1u) und den Neutronen (Masse: 1u) kaum etwas und tragen „nichts“ zur Atommasse eines Elementes bei. Sie bestimmen aber die chemischen
Eigenschaften.
1.3. Neutrale Neutronen (n=), befinden sich - ebenso wie die Protonen - im Atomkern. Sie spielen für die chemischen Eigenschaften eines Elements i. d. R. keine entscheidende Rolle, Sie beeinflussen (zusammen mit den Protonen) die Masse eines Elements.
Die Zahl der Neutronen ist häufig, aber (nicht immer) so groß wie die Zahl der Protonen. 1 Neutron wiegt ebenso wie ein Proton 1u.
Aus dem oben gesagten wird deutlich, dass für die Atommasse nur die Neutronenzahl (1 Neutron wiegt 1u) und die Protonenzahl (1 Proton wiegt 1u) entscheidend ist gilt:
Atommasse (in u) = Protonenzahl (p+) + Neutronzahl (n0)
Oder umgeformt:
Neutronenzahl (n0) = Atommasse (in u) - Protonenzahl (p+)
Vor allem für Physiker interessant ist: Die Neutronenzahl eines Elements kann variieren und so sind für ein Element mehrere Atomsorten (Isotope) denkbar.
Bsp:. Isotope des Kohlenstoffs: Alle Kohlenstoff-Atome haben die Protonenzahl (=OZ) 6, aber es gibt verschiedene Isotope des Kohlenstoffs.

Es gibt also (sehr häufig) Kohlenstoffatome mit 6 Neutronen, seltener solche mit 7 und (sehr selten) auch welche mit Neutronen.
Im Periodensystem der Elemente findet man nur die mittlere (durchschnittliche) Atommasse beträgt. Für den Kohlenstoff beträgt die mittlere Atommasse 12,011 u, da der Kohlenstoff zu gut 99% als Isotop mit einer Masse von 12 u vorkommt und die schwereren Isotope ehe selten sind. Das Isotop 14C spielt im Rahmen der Radiokarbonmethode zur Altersbestimmung kohlenstoffhaltiger, insbesondere organischer Materialien eine Rolle.
2. Ionen
Atome sind nach außen neutral. Daher gilt für Atome immer:
Elektronenzahl = Protonenzahl (=OZ)
Die Atome eines Elementes können aber auch negativ geladene Elektronen abgeben oder aufnehmen, dann entstehen positiv geladene Kationen wie Na+ und K+ oder negative geladene Anionen wie Cl-.
Zusammenfassung: Chemie für Biologen
Stunde 02: Stunde 02: Atome bestehen aus Elementarbaustenen
1. Atome bestehen aus kleineren Elementarbausteinen
Bsp.: He-Atom

Man unterscheidet:
1.1. positiv geladene Protonen (p+) im Atomkern
- entscheiden, um welches Element es sich handelt.
Alle H- Atome: 1 Proton
Alle C- Atome:6 Protonen
Immer gilt also: Protonenzahl = OZ
- ein Proton wiegt 1 u
1.2. Negativ geladene
Elektronen (e-), in der Atomhülle sind vergleichsweise
leicht. 1/2000 u.
- tragen „nichts“ zur Atommasse eines Elementes bei.
- bestimmen die chemischen Eigenschaften.
1.3. Neutrale Neutronen (n=) im Atomkern.
- beeinflussen die Masse eines Elements.
Es gilt:
Atommasse (in u) = Protonenzahl (p+) + Neutronzahl (n0)
Neutronenzahl (n0) = Atommasse (in u) - Protonenzahl (p+)
Die Neutronenzahl eines Elements kann variieren => mehrere Atomsorten (Isotope) denkbar.
Bsp:. Isotope des Kohlenstoffs: Alle Kohlenstoff-Atome haben die Protonenzahl, aber es gibt verschiedene Isotope:

2. Ionen
Atome können Elektronen abgeben oder aufnehmen, dann entstehen positiv geladene Kationen wie Na+ und K+ oder negative geladene Anionen wie Cl-.
